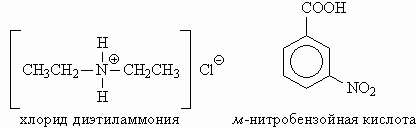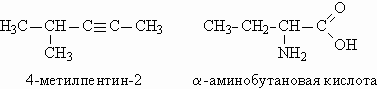|
ОТВЕТЫ И РЕШЕНИЯ ВАРИАНТ 3 (ГГФ НГУ, март 2002) 1. Nє N, 1s , 2p -связи (одна сигма- и две пи-связи). Инертность молекулы объясняется наличием очень прочной тройной связи, для разрыва которой требуется большая энергия. Способы получения оксидов азота:
2. Рассчитаем количество электронов элемента Э: Ne = 58 – 8 x 4 – 2 = 24; 24Э это Cr. Степень окисления хрома в CrO 42– +6, электронная конфигурация хрома [Ar] 3d54s1.2CrO42– + 2H+
3. а) CaCl2 – соль сильного основания Ca(OH)2 и сильной кислоты HCl, не гидролизуется. б) Гидролиз по катиону: Fe3+ + H2O Fe(OH)2+ + H2O Fe(OH)2+ + H2O Fe(OH)3 – малорастворимое соединение, вызывает помутнение раствора. в) Гидролиз по катиону: Cr3+ + H2O Cr(OH)2+ + H2O Cr(OH)2+ + H2O Cr(OH)3 – малорастворимое соединение, вызывает помутнение раствора. Для предотвращения гидролиза растворов б и в их необходимо подкислить. 4. При дегидратации одноатомных спиртов в зависимости от условий проведения реакции образуются либо простые эфиры, либо алкены.
Состав продуктов зависит и от структуры спирта. При дегидратации метанола алкен не образуется.
5. Пропан C3H8 – предельный углеводород, поэтому гидрируется только пропин: C3H4 + 2H2 = C3H8. Определим количество молей пропина n 1:16,8/22,4 = 0,75 моль H2, n 1 = 0,75/2 = 0,375 моль.При сгорании как n моль пропина, так и n моль пропана образуются 3n моль CO2, но из n 1 C3H4 образуется 2n1 моль H2O, а из n2 моль C3H8 образуется 4n2 моль H2O: C3H4 + 4O2 = 3CO2 + 2H2O, C3H8 + 5O2 = 3CO2 + 4H2O. Тогда: (2n1 + 4n2) ´ 18 = 27,9 г; (2 ´ 0,375 + 4n 2) ´ 18 = 27,9; 13,5 + 72n 2 = 27,9; 72n 2 = 14,4, n 2 = 0,2 моль. Мольная доля пропина составляет 0,375/(0,20 + 0,375) = 0,65, а массовая доля: 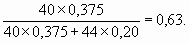
6. MgH2 + 2H2O = Mg(OH)2 + 2H2. Рассчитаем количество выделившегося водорода:
CuS + H2 = Cu + H2S. Так как для протекания реакции требуется 20 % избыток H2, то при наличии 1,0 моля водорода можно восстановить:
при М(CuS) = 96 г/моль это составит 0,83 x 96 = 80 г, тогда масса ковеллина 80/0,8 = 100 г. 7. Дигидроксохлорид алюминия – Al(OH)2Cl, дигидрат дигидрофосфата железа (II) – Fe(H2PO4)2 . 2H2O, гидросульфид бария – Ba(HS)2, гидроксид диамминсеребра (I) – [Ag(NH3)2]OH.
________________ Конец раздела |
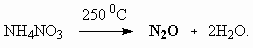
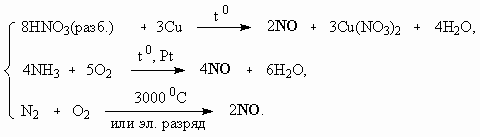
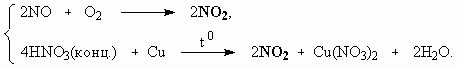
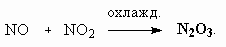
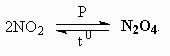
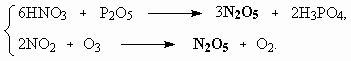
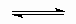 Cr2O72– + H2O.
Cr2O72– + H2O.

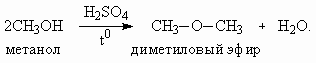
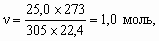
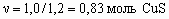 ,
,