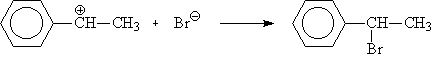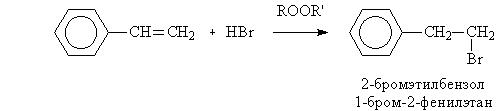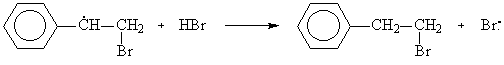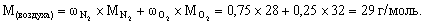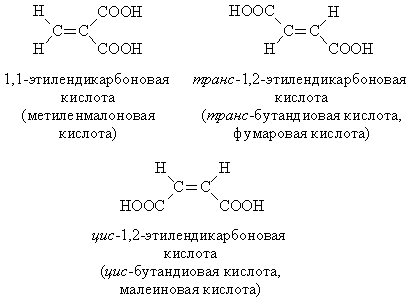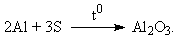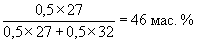|
ОТВЕТЫ И РЕШЕНИЯ ВАРИАНТ 1 (ФЕН НГУ, март 2002) 1. Все частицы в ряду O2-, F-, Ne, Na+, Mg2+, Al3+ имеют 10 электронов, их электронная конфигурация 1s22s2sp6. Так как заряд ядра в ряду от 8O до 13Al растет, возрастает и притяжение электронов к ядру, поэтому радиус частиц уменьшается. В ряду фторидов NaF, MgF2, AlF3, SiF4, PF5, SF6 электроотрицательность (ЭО) атомов от Na к S возрастает, следовательно, полярность связи падает. NaF, MgF2, AlF3 – соединения с преимущественно ионным характером связи, а SiF4, PF5, SF6 – соединения с ковалентным характером связи, их Тпл. и Ткип. должны быть ниже. Это подтверждается справочными данными:
2. Для синтеза различных производных карбоновых кислот часто используют альфа-замещенные галогенкислоты, которые можно получить при галогенировании предельных карбоновых кислот (реакция Геля–Фольгарда–Зелинского). Реакция проводится в присутствии красного фосфора:
Так как галоген легко вступает в реакцию нуклеофильного замещения, его можно заместить на аминогруппу –NH2 при действии избытка аммиака:
При последующем действии кислоты нейтрализуется избыток аммиака, а аммонийная соль превращается в кислоту (валин):
В молекуле валина тетраэдрический альфа-атом углерода связан с четырьмя различными заместителями и, следовательно, является асимметрическим, или хиральным, центром, поэтому валин может существовать в виде двух различных оптических изомеров:
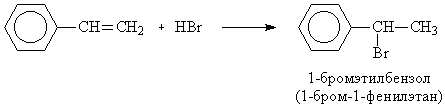
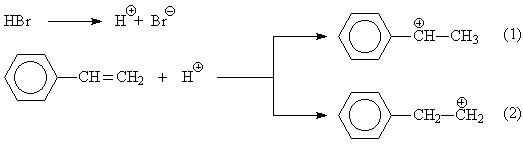
При химическом синтезе обычно образуется эквимолярная смесь оптических изомеров (рацемат), а природные аминокислоты, входящие в состав белков, как правило, являются L-изомерами. Поэтому физиологическое действие синтетических и природных аминокислот может различаться. 3. 6C(гр) + 6H2(газ) + 3O2(газ) = C6H12O6(тв.) + Qx, (1) C6H12O6 + 6O2(газ) = 6CO2(газ) + 6H2O(ж.) + Q1, (2) C(гр) + O2(газ) = CO2(газ) + Q2, (3) H2(газ) + ½O2(газ) = H2O(ж.) + Q3, (4) Складывая уравнения (1) и (2), получим: Умножим сумму уравнений (3) и (4) на 6 и вычтем из (5): 6Q2 + 6Q3 = Qx + Q1, Qx = 6Q2 + 6Q3 – Q1. 4. Частиц, проявляющих в водном растворе свойства сильных кислот, нет. Слабые кислоты: HS– + H2O Fe3+ + 2H2O HF + H2O SO2 + 2H2O Слабые основания: HS– + H2O NH3 + H2O CO32– + H2O Гидроксид алюминия и вода – амфотерные соединения, проявляют слабые кислотные и основные свойства: H2O + H2O Al(OH)3 + 2H2O Al(OH)3 5. а) В отсутствие пероксидов присоединение HBr идет по правилу Марковникова, по механизму электрофильного присоединения:
Механизм реакции электрофильного присоединения:
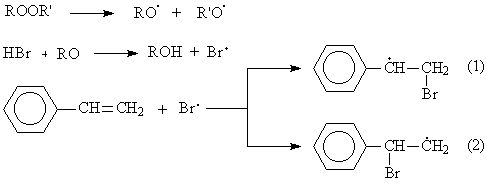
Из образующихся карбокатионов бензильный (1) значительно более устойчив, чем первичный (2), вероятность его образования намного выше, поэтому основным продуктом реакции будет 1-бромэтилбензол:
б) В присутствии пероксидов реакция протекает по механизму свободнорадикального присоединения:
Механизм реакции свободнорадикального присоединения:
Из образующихся радикалов бензильный (1) значительно более устойчив, чем первичный (2), вероятность его образования намного выше, поэтому основным продуктом реакции будет 2-бромэтилбензол:
6. LiH + H2O = LiOH + H2. а) Рассчитаем среднюю молярную массу воздуха:
По закону Архимеда грузоподъемность 1 моль водорода в воздухе равна 29 – 2 = 27 г. Поэтому, чтобы поднять 100 кг, необходимо: 100 000/27 = 3 704 моль H2 или столько же моль LiH, масса которого равна 3704 ´ 7,9 = 29 259 г, или примерно 29 кг. б) По закону Архимеда грузоподъемность 1 моль водорода в воде равна 22 400 – 2 » 22 400 г = 22,4 кг. Следовательно, чтобы удержать на плаву 100 кг, необходимо 100/22,4 = 4,5 моль H2 или столько же моль LiH, масса которого равна 4,5 ´ 7,9 = 35 г. 7. RCOOH + NaOH = RCOONa + H2O. По этому уравнению количество моль монокарбоновой кислоты равно количеству моль щелочи и составляет 0,020 ´ 0,200 = 0,004 моль. Рассчитаем молярную массу кислоты: М = 0,232/0,004 = 58 г/моль. Из общей формулы карбоновой кислоты RCOOH следует, что ее молярная масса М = M(R) + 12 + 2 ´ 16 + 1 = М(R) + 45, отсюда М(R) = 58 – 45 = 13 г/моль, однако алкильного радикала с такой молярной массой не существует. Таким образом, кислота является не монокарбоновой, а дикарбоновой, ибо трикарбоновой эта кислота не может быть из-за ограничения по молярной массе. Уравнение для дикарбоновой кислоты – R(COOH)2 + 2NaOH = R(COONa)2 + 2H2O, М = 0,232/(0,004/2) =116 г/моль; М(R) = 116 – 45 ´ 2 = 26 г/моль, что соответствует составу R º C2H2. Возможные структуры дикарбоновой непредельной кислоты:
8. В зависимости от исходного соотношения Al и S возможны варианты состава продуктов реакции: а) Al2S3, б) Al2S3 + S, в) Al2S3 + Al. Выделение газообразных продуктов может происходить в результате следующих реакций: Al2S3 + 6H+ = 2Al3+ + 3H2S , 2Al + 6H+ = 2Al3+ + 3H2 , 2Al + 6OH– + 6H2O = 2[Al(OH)6]3– + 3H2 . Из условия, что при кислотной обработке выделилось больше газообразных продуктов, чем при щелочной, следует, что состав продуктов соответствует варианту в. Пусть при щелочной обработке выделилось х моль H2, тогда при кислотной 3х. При кислотной и щелочной обработке в реакции с Al образуется одинаковое количество H2, т. е. при реакции кислоты с Al2S3 выделилось 2х моль H2. Значит, в смеси содержится 2/3х моль Al и 2/3х моль Al2S3, т. е. в исходной смеси содержались эквимолярные количества Al и S, или по 50 мол. %. Рассчитаем массовый процент Al:
________________ Конец раздела | ||||||||||||||||||||||
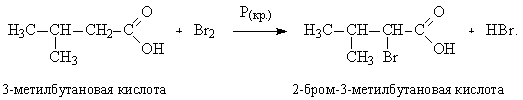
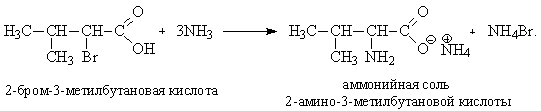
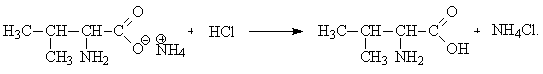
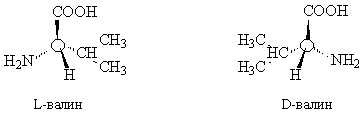
 H3O+ + S2–,
H3O+ + S2–,