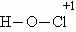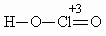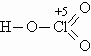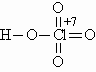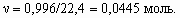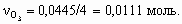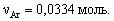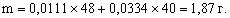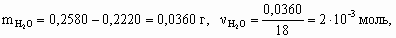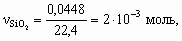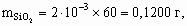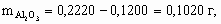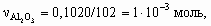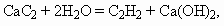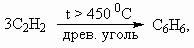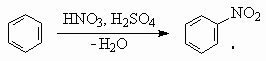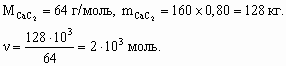|
ОТВЕТЫ И РЕШЕНИЯ ВАРИАНТ 6 (ГГФ, июль 2003) 1. FeO – оксид железа (II), или монооксид железа, Fe3O4 – оксид железа (II, III), или тетраоксид трижелеза, Fe2O3 – оксид железа (III), или триоксид дижелеза. Гидроксид Fe(II) проявляет более сильные основные свойства, чем гидроксид Fe(III): Fe(OH)2 + 2H+ = Fe2+ + 2H2O, Fe(OH)2 + 2OH–(конц.) = Fe(OH)42–. Кислые свойства выражены сильнее у гидроксида Fe(III): Fe(OH)3 + 3H+ = Fe3+ + 3H2O, Fe(OH)3 + OH–(конц.) = FeO2– + 2H2O. 2. а) NH3 + H2SO4(изб.) = NH4HSO4 – гидросульфат аммония; б) CO2 + Na2CO3(изб.) + H2O = 2NaHCO3 – гидрокарбонат натрия; в) 3H2S + 2KMnO4(изб.) = 3S + 2MnO2 + 2KOH + 2H2O; (образуются сера, оксид марганца (IV), гидроксид калия) г) SO2 + 2KOH(изб.) + H2O2 = K2SO4 + 2H2O – сульфат калия. 3. Все ароматические атомы углерода имеют sp2-гибридизацию, атомы углерода боковых цепей – sp3. 4. Кислородсодержащие кислоты хлора:
5. Считая смесь аргона и озона идеальным газом, рассчитаем количество моль газа:
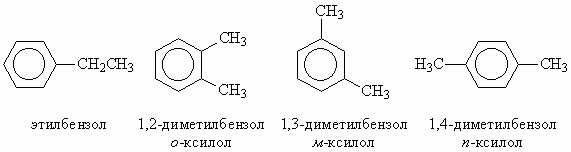
Количество моль озона в три раза меньше, чем аргона:
Рассчитаем массу смеси:
6. Рассчитаем количество частиц OH– в 150 мл 0,8 % раствора NaOH: 0,8/40 = 2× 10–2 моль OH– в 100 мл растворара, в 150 мл – 3× 10–2 моль OH–. Из них 0,2 ´ 0,05 = 0,01 моль прореагировало при смешении с HCl, осталось 0,02 моль. Для их нейтрализации потребуется 0,02/0,5 = 0,04 л, или 40 мл 0,2 М HCl. 7. Рассчитаем количество моль каждого оксида в минерале:
x : y : z = 1 : 2 : 2. Состав минерала: Al2O3 × 2SiO2 × 2H2O. 8.
На второй стадии из 3 моль ацетилена образуется 1 моль бензола, поэтому при 100 % выходе образовалось бы 2/3× 103 моль нитробензола. С учетом 80 % выхода на каждой из 3-х стадий выход нитробензола составит (0,8)3 ´ 100 % = 51 %. М(С6Н5NO2) = 123 г/моль. m(С6Н5NO2) = 0,67× 103 ´ 0,51 ´ 123 = 42 029 г, или 42 кг. ________________ Конец раздела | ||||||||||||||||