1. ФОРМАЛЬНАЯ КИНЕТИКА
Определение
энергии активации
1.4.1.
Вычислите
энергию активации
реакции, скорость которой увеличилась вдвое при повышении температуры от 30 до
40 °С.
1.4.2.
Для
обратимой реакции А ![]() В найдите выражение для температуры, обеспечивающей
максимальную начальную
скорость реакции, если в начальный момент времени CA(0) = a, CB(0)
= b.
В найдите выражение для температуры, обеспечивающей
максимальную начальную
скорость реакции, если в начальный момент времени CA(0) = a, CB(0)
= b.
1.4.3.
При
радиолизе жидкого декана (r = 0,73 г/см3) стационарная концентрация
метильных радикалов составляет 10–4 моль/л. При какой
температуре реакция ![]() может конкурировать с
реакцией
может конкурировать с
реакцией ![]() , если предэкспоненциальные множители констант скоростей
одинаковы, а энергии активации равны соответственно Е1 = 10 ккал/моль и Е2 = 1 ккал/моль?
, если предэкспоненциальные множители констант скоростей
одинаковы, а энергии активации равны соответственно Е1 = 10 ккал/моль и Е2 = 1 ккал/моль?
1.4.4.
(Пе1–2006, № 1). При измерении зависимости
константы скорости бимолекулярной реакции от температуры были получены
следующие результаты:
|
T, С |
200 |
235 |
270 |
320 |
|
k2, M–1мин–1 |
1,2 |
1,5 |
1,9 |
2,5 |
Найдите
графическим методом энергию активации.
1.4.5.
Для
реакции первого порядка N2O5 ¾® 2 NO2 + ½ O2
константа скорости при разных температурах имеет
следующие значения:
|
T, K |
273 |
298 |
308 |
318 |
328 |
338 |
|
(k × 105) c–1 |
0,0787 |
3,46 |
13,5 |
49,8 |
150 |
487 |
Найдите
энергию активации и предэкспоненциальный фактор.
1.4.6.
Вычислите
энергию активации и предэкспоненциальный множитель константы скорости реакции
на основании следующих данных:
|
Т, °С |
356 |
427 |
508 |
|
k, с–1 |
0,0295 |
1,15 |
39,6 |
1.4.7.
Определите
энергию активации и предэкспоненциальный множитель константы скорости из следующей
зависимости времени полупревращения от температуры:
|
Т,
°С |
529,5 |
538,5 |
550,5 |
560,5 |
569,5 |
|
t1/2, с |
66,5 |
44,3 |
29,6 |
19,3 |
14,6 |
Реакция исследовалась в
реакторе постоянного объёма с начальной концентрацией реагента
1,8 · 1016 см–3. Порядок реакции по исходному
веществу равен 2.
1.4.8.
Определите
энергию активации и предэкспоненциальный множитель константы скорости
реакции димеризации циклопентадиена,
если известно, что константа скорости этой реакции изменяется с температурой
следующим образом:
|
T, K |
350 |
370 |
390 |
410 |
430 |
|
k, M–1×с–1 |
5,8 × 10–5 |
2 × 10–4 |
6,2 × 10–4 |
2 × 10–3 |
5 × 10–3 |
1.4.9.
При
изучении распада перекисных радикалов в облученном политетрафторэтилене
получены следующие значения константы скорости реакции при разных температурах:
|
T, °C |
105 |
125 |
145 |
175 |
205 |
225 |
|
k, с–1 |
3,7 × 10–4 |
1,4 × 10–3 |
1 × 10–2 |
2,2 × 10–2 |
4 × 10–2 |
2 × 10–1 |
Определите
из этих данных энергию активации и предэкспоненциальный множитель.
|
1.4.10. Для последовательной реакции |
|
1.4.1.
В
газовой фазе идёт мономолекулярная обратимая реакция А ![]() В. Тепловой эффект реакции DН = +11,3 ккал/моль. Измерения давления
вещества А при различных температурах
в зависимости от времени дали следующие результаты:
В. Тепловой эффект реакции DН = +11,3 ккал/моль. Измерения давления
вещества А при различных температурах
в зависимости от времени дали следующие результаты:
|
|
T = |
T = |
||||
|
t, мин |
0 |
10 |
200 |
300 |
0 |
10 |
|
PA, мм рт. ст. |
100 |
83,4 |
35 |
35 |
100 |
37,4 |
Определите энергии
активации прямой и обратной реакции.
1.4.2.
При
достаточно низких давлениях пиролиз йодистого этила может идти двумя
параллельными путями:
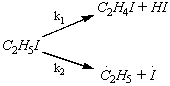
Проведите расчёт энергии активации для суммарного
процесса при 750 К, учитывая, что при этой температуре k1/k2 = 2,5,
а энергии активации реакций равны: Е1 = 52,8 ккал/моль,
Е2 = 50,0 ккал/моль.
1.4.3.
Изучая
зависимости скоростей реакций в водных растворах от температуры, Вант-Гофф
предложил эмпирическое правило: с ростом температуры на 10 °С скорость реакции
возрастает в 2–4 раза. Какому диапазону значений энергий активации
соответствует правило температурного коэффициента Вант-Гоффа?
1.4.4. Реакция в газе идёт бимолекулярным путем с
энергией активации на 42 кДж/моль меньшей, чем энергия активации по
мономолекулярному пути. При каких температурах эта реакция идёт быстрее по
мономолекулярному пути при атмосферном давлении? Значения предэкспоненциальных множителей считать нормальными.
1.4.5.
(Экз–2004,
№ 3). Реакция восстановления трехвалентного железа тиосульфатом
2 Fe3++ 2 S2O32–
¾® 2 Fe2++ S4O62–
при исследованных концентрациях реагентов имеет порядок 1,5 по Fe3+ и 0,5
– по тиосульфату. Зависимость времени полупревращения от температуры приведена
в таблице. Начальные концентрации Fe(III) и
тиосульфата одинаковы и равны 7 × 10–4 М.
Определите энергию активации и наблюдаемый предэкспоненциальный множитель.
|
T, K |
t1/2, с |
|
293 |
285 |
|
303 |
95 |
1.4.6.
(КР1–2005,
№ 3). До того, как в 1889 году Аррениус предложил своё знаменитое уравнение для
описания зависимости константы скорости от температуры, разными авторами
применялись различные эмпирические формулы. Например, в 1885 году Худ использовал
для температурной зависимости реакции окисления железа под действием ![]() (H2SO4) следующее уравнение:
(H2SO4) следующее уравнение:
|
Предлагаемое
уравнение для k: |
Температурный диапазон T, K |
|
|
283–303 |
Чему равна энергия активации этой
реакции, если полученные данные описать уравнением Аррениуса?
1.4.17.
В
трубу подаётся струя газа со скоростью потока 10 см/с, содержащая 1016 см–3
свободных радикалов R которые гибнут с
константой скорости 2,4 с–1, не зависящей от температуры. В конце
трубы концентрация свободных радикалов очень мала (труба достаточно длинная). В
начале трубы в струю подмешивается вещество Y,
способное реагировать со свободными радикалами по реакции ![]() . Давление вещества Y
в начале трубы 2 мм рт. ст. Продукт Z улавливается в ловушке. За один час при 400 К в ловушке
накопилось 0,5 ммоль вещества Z,
при Т = 500 К накопилось 1,45 ммоль. Найдите k0 и Е этой реакции.
. Давление вещества Y
в начале трубы 2 мм рт. ст. Продукт Z улавливается в ловушке. За один час при 400 К в ловушке
накопилось 0,5 ммоль вещества Z,
при Т = 500 К накопилось 1,45 ммоль. Найдите k0 и Е этой реакции.
1.4.18.
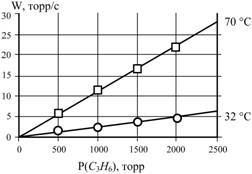
(Экз–2005, № 2).
При исследовании полимеризации пропилена была получена следующая зависимость
скорости полимеризации от давления мономера.
Определите порядок реакции и энергию активации реакции.
1.4.19.
(Пе3–2004, № 2). При g-облучении
кристаллов MgO образуются свободные электроны e–, которые могут захватываться ловушками двух
типов:
1) e– + A ![]() A–,
A–,
2) e– + B ![]() B–.
B–.
Отношение
скоростей образования ионов A– и B– при температурах 77 и 100 К равно
2 и 6 соответственно. Определить энергию активации Е2 реакции 2, если Е1 = 2,1 ккал/моль.
1.4.20.
(КР1–2006, № 4). Найдите графическим методом энергию активации и предэкспоненциальный
множитель реакции дегидрирования этилового спирта.
|
Температура, °С |
216 |
228 |
247 |
261 |
|
k × 103, с–1 |
1,13 |
1,65 |
3,22 |
5,82 |