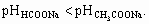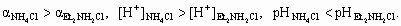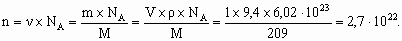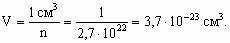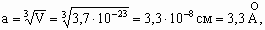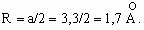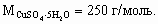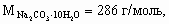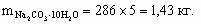|
ОТВЕТЫ И РЕШЕНИЯ ВАРИАНТ 2 (ФЕН НГУ, март 2002) 1. В ряду от N к Bi размер атома растет, так как увеличение главного квантового числа (n) и числа электронных слоев – более сильный фактор, чем увеличение притяжения электронов к ядру с пропорционально растущим зарядом. Кислотно-основные свойства гидратированных оксидов элементов зависят от поляризации и прочности связей Э–O и O–H. Поэтому гидролиз группы Э–O–H может протекать по двум путям:
В соединении O=N–OH связь N–O прочнее, чем связь Bi–O в Bi(OH)3, так как RN < RBi, а RN примерно равна RO, электронная пара s св.(N–O) расположена близко от ядер N и O, и притяжение более сильное, чем между ядрами O и H. В соединении Bi(OH)3, RBi >> RO, “перекрывание” неэффективное, связь O–H оказывается прочнее, чем Bi–O.Эти рассуждения подтверждаются справочными данными для констант диссоциации этих соединений как кислот или оснований:
2. В зависимости от взаимного расположения двойных связей алкадиены делятся на 3 класса: а) с кумулированными двойными связями (аллены); б) с сопряженными двойными связями (сопряженные диены); в) с изолированными двойными связями.
Для всех алкадиенов характерны реакции ступенчатого присоединения электрофильного или свободнорадикального типа. Изолированные двойные связи в пентадиене-1,4 реагируют независимо друг от друга, т. е. так, как если бы они находились в разных молекулах:
При взаимодействии бутадиена-1,3 с HBr на первой ступени образуется смесь продуктов 1,2- и 1,4-присоединения:
Следовательно, различие алкадиенов с сопряженными и несопряженными связями заключается в том, что две сопряженные двойные связи в алкадиене проявляют себя в реакциях как единая p-система ("пи"-система). Одной из наиболее важных областей применения сопряженных диенов является полимерная промышленность, где они являются сырьем для каучуков:
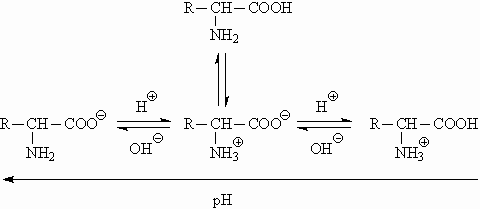
3. Аминокислоты являются амфотерными соединениями, поэтому в водных растворах в зависимости от рН могут существовать в виде анионов, катионов или цвиттер-ионов:
4. Пропан C3H8 – предельный углеводород, поэтому гидрируется только пропин: C3H4 + 2H2 = C3H8. Определим количество молей пропина n 1:16,8/22,4 = 0,75 моль H2, n 1 = 0,75/2 = 0,375 моль.При сгорании как n моль пропина, так и n моль пропана образуются 3n моль CO2, но из n 1 C3H4 образуется 2n 1 моль H2O, а из n 2 моль C3H8 образуется 4n 2 моль H2O:C3H4 + 4O2 = 3CO2 + 2H2O, C3H8 + 5O2 = 3CO2 + 4H2O. Тогда: (2n 1 + 4n 2) ´ 18 = 27,9 г; (2 ´ 0,375 + 4n 2) ´ 18 = 27,9; 13,5 + 72n 2 = 27,9; 72n 2 = 14,4, n 2 = 0,2 моль. Мольная доля пропина составляет 0,375/(0,20 + 0,375) = 0,65, а массовая доля: 5. Один моль молекулярного водорода содержит 2 моль атомов H, такое же количество моль атомов H содержат 2 моль LiH, которые занимают объем:
1 моль идеального газа занимает 22,4 литра при Т = 0 0С и давлении 1 атм, по закону Бойля–Мариотта PV = const, значит, 1 моль в объеме 20,3 см3 будет создавать давление:
6. а) CH3COONa = Na+ + CH3COO–, CH3COO– + H2O a 0,1 > a 0,4. б ) HCOONa = Na+ + HCOO–,HCOO– + H2O в) 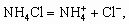
NH4+ + H2O Et2NH2+ + H2O Этильные группы в молекуле диэтиламина обладают положительным индуктивным эффектом, поэтому электронная плотность на азоте диэтиламина выше, чем в молекуле аммиака. Таким образом, диэтиламин является более сильным основанием, чем аммиак и его соли гидролизуються в меньшей степени. г ) Fe3+ + H2O Fe(OH)2+ + H+, Fe(OH)2+ + H+,
Fe(OH)2+ + H2O Fe(OH)2+ + H2O При снижении температуры снижается и степень гидролиза. Для предотвращения гидролиза в случаях а и б необходимо добавить щелочи, в случаях в и г – кислоты. 7. Рассчитаем количество атомов в 1 см3 кристалла Ро:
Объем одного кубика, в каждой из вершин которого находятся атомы, составит:
Зная объем кубика, можно рассчитать величину его ребра и радиус атома:
8. 3CuSO4 + 3Na2CO3 + 2H2O = (CuOH)2CO3·Cu(OH)2 + 3Na2SO4 + 2CO2. В одном килограмме медного купороса содержится 4 моль вещества, т. е. для реакции с учетом избытка требуется 5 моль соды.
По уравнению реакции из 3 моль медного купороса получается 1 моль продукта, тогда из 4 моль – 1,33 моль соответственно. M[(CuOH)2CO3·Cu(OH)2] = 320 г/моль, m[(CuOH)2CO3·Cu(OH)2] = 320 ´ 1,33 = 427 г. ________________ Конец раздела | ||||||||||||||||
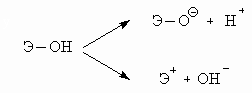
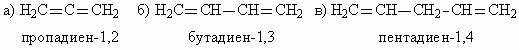

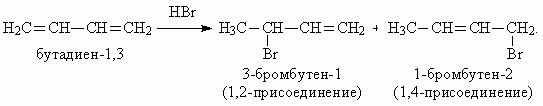
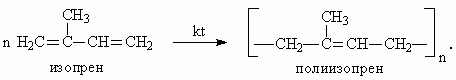
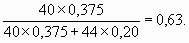
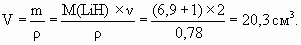
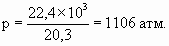
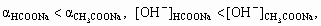 т. е.
т. е.