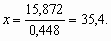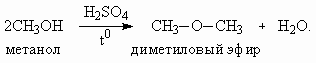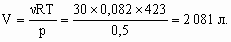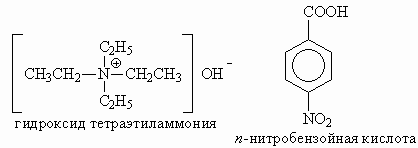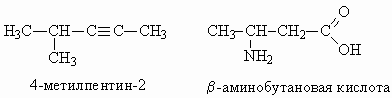|
ОТВЕТЫ И РЕШЕНИЯ ВАРИАНТ 4 (ГГФ НГУ, март 2002) 1. Nє N, 1s , 2p -связи (одна сигма- и две пи-связи). Инертность молекулы объясняется наличием очень прочной тройной связи, для разрыва которой требуется большая энергия. Способы получения оксидов азота:
2. а) CH3COOK = K+ + CH3COO–, CH3COO– + H2O KCN = K+ + CN–, CN– + H2O
б ) NH4NO3 = NH4+ + NO3–,NH4+ + H2O (C2H5)3NHNO3 = (C2H5)3NH+ + NO3–, (C2H5)3NH+ + H2O
Объяснение дано в задаче 6 (пункт в) Варианта 2. При снижении температуры и повышении концентрации соли степень гидролиза понижается. Для предотвращения гидролиза в случае а необходимо добавить щелочи, в случае б – кислоты. 3. Обозначив за х – молярную массу элемента Э в соединении CaЭ2O2, составим уравнение:
Элемент Э – Cl, соль – гипохлорит кальция Ca(ClO)2 , кислота – HClO (хлорноватистая). Эту соль можно получить при хлорировании гидроксида кальция:2Cа(OH)2 + Cl2 = Ca(ClO)2 + CaCl2 + 2H2O. 4. При дегидратации одноатомных спиртов в зависимости от условий проведения реакции образуются либо простые эфиры, либо алкены.
Состав продуктов зависит и от структуры спирта. При дегидратации метанола алкен не образуется.
5. При pH = 11 [OH–] = 10–3 моль/л, т. е. в 100 мл раствора (в 1 г удобрения) содержится 10–4 моль KOH. Тогда в 1 т удобрения содержится 102 моль KOH, столько же моль азотной кислоты потребуется для реакции ее нейтрализации: M(HNO3) = 1 + 14 + 3 ´ 16 = 63 г/моль, m(HNO3) = 63 ´ 102 = 6,3× 103 г, тогда m[HNO3(65 %)] = 6,3×
103/0,65 = 9,69×
103 г; при плотности 6. Тритий (3H) – самый тяжелый изотоп водорода, в его состав входят 1e, 1p, 2n. В составе изотопа 18О – 8e, 8p, 10n. Тогда в молекуле Т2О – 10e, 10p, 14n, а на 1 моль приходится: Ne = Np = 10 ´ NA = 6,02× 1024, Nn = 14 ´ NA = 8,43× 1024. M(Т2О) = 24 г/моль, n = 720/24 = 30 моль,
7. Гидроксохлорид магния – Mg(OH)Cl, гексагидрат гидрофосфата железа (III) – Fe2(HPO4)3 × 6H2O, нитрид алюминия – AlN, хлорид диамминсеребра (I) – [Ag(NH3)2]Cl.
________________ Конец раздела |
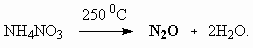
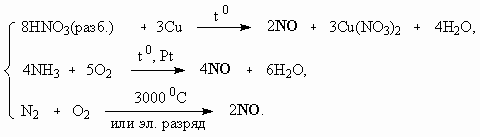
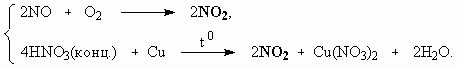
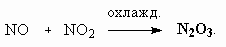
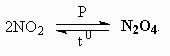
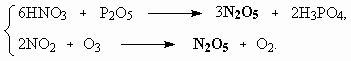
 CH3COOH + OH–,
CH3COOH + OH–, 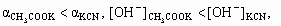
 .
.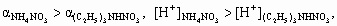

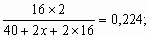 32 = 16,128 + 0,448х;
32 = 16,128 + 0,448х;