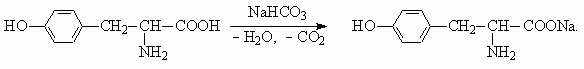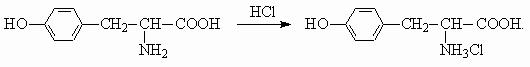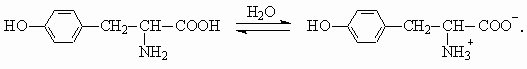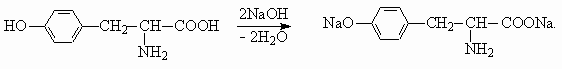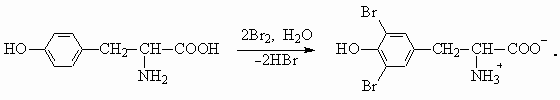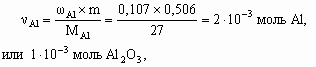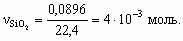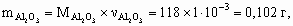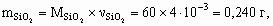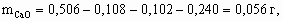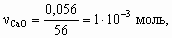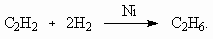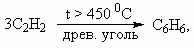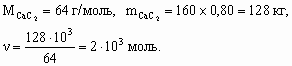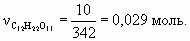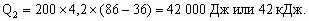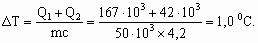|
ОТВЕТЫ И РЕШЕНИЯ ВАРИАНТ 5 (ФЕН НГУ, июль 2002) 1. Самый легкий метал VIII группы – железо. Fe – степень окисления – (0), 2. Для нахождения растворов, поглощающих газы, можно составить следующую таблицу, где знак “+” обозначает протекание химических реакций:
_______________ * Реакция протекает с кислотой. Для каждого газа достаточно написать по одному из приведенных ниже уравнений реакций с поглотителем: 2KMnO4 + C2H2 + 3H2SO4 = 2CO2 + 2MnSO4 + K2SO4 + 4H2O, 8KMnO4 + 5H2S + 7H2SO4 = 8MnSO4 + 4K2SO4 + 12H2O (в зависимости от концентрации и температуры возможно также окисление H2S до S). 2[Ag(NH3)2]OH + CO2 = Ag2CO3↓ + 4NH3 + H2O, 2[Ag(NH3)2]OH + Cl2 + 9H2O = AgClO + AgCl↓ + 4NH3 + H2O, 2[Ag(NH3)2]OH + C2H2 =AgCº CAg↓ + 4NH3 + 2H2O, 2[Ag(NH3)2]OH + H2S = Ag2S↓ + 4NH3 + 2H2O, Na2CO3 + CO2 + H2O = 2NaHCO3, Na2CO3 + Cl2 = NaClO + NaCl + CO2, H2SO4 + CH3NH2 = [CH3NH3]+HSO4–. 3.
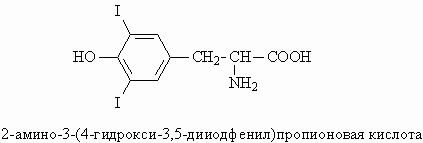
Для тирозина характерны реакции с кислотами и основаниями, как для всех альфа -аминокислот, в водном растворе тирозин существует в виде цвиттер-ионного соединения. Также тирозин вступает в реакции, характерные для фенолов.а) Вытеснение более слабой (угольной кислоты) из гидрокарбоната натрия:
б) Образование соли:
в) Образование цвиттер-иона при растворении в воде:
г) Образование динатриевой соли при взаимодействии со щелочью:
д) Реакция электрофильного замещения:
4. а) M[Mg(NO3)2] = 148 г/моль; M[MgCl2× 6H2O] = 203 г/моль; M[MgSO4× 7H2O] = 246 г/моль; Масса 50 мл раствора с r = 1,1 г/см3 – 55 г, в 100 г 13,5 % раствора содержится 13,5 г Mg(NO3)2, тогда в 55 г – 13,5 ´ 55/100 = 7,42 г, или 7,42/148 = 5× 10–2 моль Mg2+. В 2,03 г MgCl2× 6H2O содержится 1× 10–2 моль Mg2+, а в 2,46 г MgSO4× 7H2O – 1× 10–2 моль Mg2+. Всего в 50 мл раствора находится 5× 10–2 + 1× 10–2 + 1× 10–2 = 7× 10–2 моль Mg2+.Концентрация Mg2+ в растворе составит 0,07/0,05 = 1,4 моль/л.б) Для реакции Mg2+ + 2OH– = Mg(OH)2 с учетом полуторакратного избытка потребуется 7× 10–2 ´ 2 ´ 1,5 = 0,21 моль OH–. Это составит 210 мл 1 М раствора NaOH (pH = 14).5. Рассчитаем количество моль каждого оксида в минерале.
Рассчитаем массу каждого оксида в минерале.
x : y : z : u = 1 : 1 : 4 : 6, Состав минерала: СаО × Al2O3 × 4SiO2 × 6H2O.6. M < 32 г/моль. Это непредельный углеводород с числом углеродных атомов не более 2 (этилен или ацетилен). По соотношению объемов углеводорода и водорода (1 : 2) в реакции гидрирования следует, что это ацетилен:
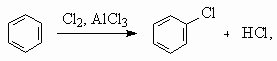
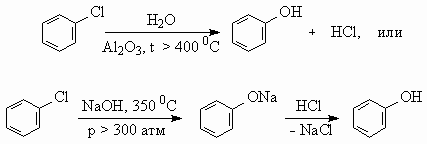
7.
На второй стадии из 3 моль ацетилена образуется 1 моль бензола, поэтому при 100 % выходе образовалось бы 2/3× 103 моль фенола. С учетом 80 % выхода на каждой из 4-х стадий выход фенола составит (0,8)4 ´ 100 % = 41 %. М(С6Н5ОН) = 94 г/моль. m(С6Н5ОН) = = 0,67× 103 ´ 0,41 ´ 94 = 25 822 г, или 25,8 кг.Для альтернативного варианта синтеза с 5 стадиями выход фенола составит: 0,67× 103 ´ (0,8)5 ´ 94 = 20 637 г, или 20,6 кг.8. а) C12H22O11 + 12O2 = 12CO2(газ) + 11H2O(ж) + Q, Q = 12 ´ 394 + 11 ´ 286 – 2128 = 5746 кДж/моль. М(C12H22O11) = 342 г/моль. При окислении 10 г сахарозы выделится Q1 = 5746 ´ 0,029 = 167 кДж. б) Q = mcD T, где с – удельная теплоемкость. При охлаждении 200 г горячего чая выделится
в) При средней массе абитуриента 50 кг рассчитаем повышение температуры его тела:
________________ Конец раздела | |||||||||||||||||||||||||||||||