1. ФОРМАЛЬНАЯ КИНЕТИКА
1.3. Интегрирование
кинетических уравнений
Обратимая реакция
1.3.16. Для
обратимой реакции
A ![]() B
B
начальные
давления равняются PA(0) = 104 Па, PB(0)
= 0. Через 10 с после начала реакции РА = РВ = 5 × 103 Па.
Определите
РА через 20 с после
начала реакции, если k1/k–1 = 3.
1.3.17. (КР1–1997, № 1). В реактор, находящийся при
температуре 900 К, напускают цис-дихлорэтилен,
который может изомеризоваться в транс-дихлорэтилен:
cis-CHCl=CHCl ![]() trans-CHCl=CHCl.
trans-CHCl=CHCl.
Найдите
время, через которое концентрация транс-дихлорэтилена
будет отличаться от равновесного значения на 1 %.
Аррениусовские энергии активации (Е) и предэкспоненты
(А) констант скорости для прямой и обратной реакции равны:
E1 = 56,0 ккал/моль log10A1(c–1) = 12,8;
E–1 = 55,3 ккал/моль log10A2(c–1) = 12,7.
1.3.18. В
замкнутом объёме протекает обратимая реакция
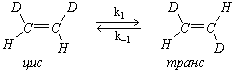
В начальный момент времени концентрация цис-изомера равна 10–2 моль/л, а
концентрация транс-изомера
равна нулю. Определите, пренебрегая различием масс H и D, концентрацию транс-изомера
через 10 с, если k1 = 10–1 c–1.
1.3.19. Найдите
связь между константами скорости прямой и обратной реакции, равновесными
концентрациями и временем релаксации к равновесию t для трёх типов реакций
1) A ![]() B,
B,
2) A ![]() B + C,
B + C,
3) ![]() B,
B,
считая, что отклонение от равновесия, вызванное
внешним воздействием, невелико.
1.3.20. Чему равно
время релаксации к равновесию для реакции диссоциации воды
H2O ![]() H+ + OH–,
H+ + OH–,
если k1 = 3 × 10–5 c–1,
k–1 = 1,5 × 1011 М–1c–1?
1.3.21. Величину
pH водного раствора скачком изменили от 7,1 до 7,0.
Оцените время релаксации электролитической диссоциации, если рекомбинация ионов
Н+ и ОН– происходит при каждом
столкновении (т. е. k = 1011 М–1c–1).
1.3.22. Реакция
нейтрализации
Н3О+ + ОН– ¾® 2 H2O
характеризуется константой скорости 1011 М–1с–1.
Определите среднее время жизни атомов водорода в составе молекулы воды.
1.3.23. Для
обратимой реакции
А ![]() В
В
константа равновесия K = 1,12,
константа скорости k1 = 1,6 × 10–6 c–1,
а отношение начальных концентраций [A]0/[B]0 = 3. Какое
время необходимо, чтобы концентрация А уменьшилась на 30 % от исходной?
1.3.24. Превращение вещества A в вещество В
протекает по двум параллельным реакциям:
1) по обратимой реакции
первого порядка
А ![]() В,
В,
2) по обратимой реакции
второго порядка с участием иона водорода
A + H+ ![]() B + H+.
B + H+.
Найдите
константу k1, если известны константы k–1,
k2 и k–2.
1.3.25. При
исследовании обратимой реакции диссоциации гексафенилэтана
на трифенилметильные радикалы в толуоле была получена
следующая зависимость концентрации радикалов от времени при
|
t, c |
1 |
3 |
5 |
10 |
20 |
30 |
40 |
|
|
2,5 |
7,5 |
11,5 |
19 |
24 |
25 |
25 |
Начальная концентрация гексафенилэтана в этом опыте была 0,001 моль/л. Определите по этим результатам константы скорости прямой
и обратной реакции.
1.3.26. (КР1–2000, № 4). Получите зависимость
концентрации вещества A от времени для реакции:
2 А ![]() X
X
В начальный момент времени [A] = a, [X] = 0.
1.3.27. (КР1–2006, № 5). Один из методов оценки
возраста биологических объектов основан на измерении содержания в них
оптических изомеров аминокислот. В живых организмах отношение концентраций D- и L-изомеров
постоянно ([D]0/[L]0 = а). В мёртвых организмах происходит рацемизация
L ![]() D,
D,
причём константы скорости прямой
и обратной реакции одинаковы k1 = k–1 = k. Чему равен возраст ископаемого биологического объекта, содержащего
аспарагиновую кислоту (k = 1,48 × 10–5
лет–1; a =
0,07), в котором [D]/[L] = 0,27?