2. АБСОЛЮТНЫЕ ЗНАЧЕНИЯ
СКОРОСТЕЙ ХИМИЧЕСКИХ РЕАКЦИЙ
2.6. Теория Линдемана
2.6.1. Покажите, как учёт нарушения равновесного
распределения молекул по энергиям влияет на скорость газофазной химической
реакции (теория Линдемана).
2.6.2. Оцените давление, при котором для
мономолекулярной реакции наблюдаемая константа скорости будет в два раза меньше
константы скорости, соответствующей равновесному распределению по энергии.
2.6.3. При каких давлениях реакция ![]() будет описываться
кинетическим уравнением 3-го порядка, если распад возбуждённого радикала
будет описываться
кинетическим уравнением 3-го порядка, если распад возбуждённого радикала ![]() происходит с
вероятностью 10–4 при каждом колебании, а дезактивация
осуществляется при каждом двойном соударении?
происходит с
вероятностью 10–4 при каждом колебании, а дезактивация
осуществляется при каждом двойном соударении?
2.6.4. Оцените энергию диссоциации двухатомной молекулы X–Y
в газе, состоящем только из молекул X–Y,
если известно, что при 2000 К время полураспада X–Y составляет 103 с при концентрации 1017 молекул/см3
и 104 с при концентрации 1016 молекул/см3.
Диссоциацию считать необратимой.
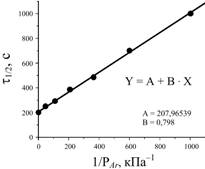
2.6.5. (КР2–2004, № 2). На рисунке показана зависимость времени
полупревращения t1/2
в реакции мономолекулярного раз-ложения ацетальдегида в газовой фазе в
присутствии аргона от величины 1/PAr (кПа–1), где PAr – давления аргона.
Условия эксперимента: температура 822 К, начальное
давление ацетальдегида 10–1 Па. Рассчитайте по этим данным константы
скоростей стадии активации молекулы ацетальдегида и стадии распада возбуждённой
молекулы ацетальдегида на продукты реакции, если константа дезактивации
возбуждённых молекул ацетальдегида kД = 10–10 см3/с.
2.6.1. Термическая изомеризация циклопропана в
пропилен изучена при 500 °С и различных начальных давлениях.
Экспериментальные данные приведены в таблице.
|
Р0, торр |
2,89 |
0,57 |
0,17 |
0,12 |
0,10 |
|
kэфф × 104,
с–1 |
1,67 |
1,00 |
0,50 |
0,38 |
0,33 |
Здесь kэфф определяли как начальную
скорость, делённую на начальную концентрацию. Определите константы скорости
активации циклопропана и изомеризации активированных молекул, если дезактивация
происходит при каждом соударении.
2.6.2. (Экз–2003, № 5). Образование диоксида азота в
избытке азота протекает по схеме
O +
NO ![]() NO2*,
NO2*,
![]()
![]() NO2 + N2.
NO2 + N2.
Считая, что дезактивация происходит при каждом
столкновении, найдите эффективную константу скорости реакции образования NO2, если ![]() , K* = 4 × 10–3 М–1, T = 300 К.
, K* = 4 × 10–3 М–1, T = 300 К.
2.6.3. Оцените энергию диссоциации двухатомной
молекулы А–В в газе, состоящем только из молекул А–В, если известно, что при 1000 К
время полураспада А–В
составляет 103 с при концентрации 1017 молекул/см3
и 104 с при концентрации 1016 молекул/см3.
Диссоциацию считать необратимой.