2. АБСОЛЮТНЫЕ ЗНАЧЕНИЯ
СКОРОСТЕЙ ХИМИЧЕСКИХ РЕАКЦИЙ
2.7. Туннельные процессы
2.7.1. Покажите, как туннелирование
ядер влияет на низкотемпературный предел скорости химической реакции.
2.7.2. В реакции изомеризации
CH3CH2![]() HCH3 ¾® CH3
HCH3 ¾® CH3![]() HCH2CH3
HCH2CH3
происходит
туннельный перенос протона с константой скорости 10 с–1.
Оцените кинетический изотопный эффект при замене Н на D.
2.7.3. Выведите выражение, описывающее изменение во
времени концентрации пар частиц D и А, гибнущих в
туннельной реакции
D + A ¾® D+
+ A–,
при
прямоугольной функции распределения пар D...A
по расстоянию R между частицами D
и A в пáрах.
2.7.4. При импульсном облучении образцов керамики
(длительность импульса 3 пс, мощность в импульсе
3,7 ГВт) образуются электронные «e» и дырочные «h» центры. Их рекомбинация при Т = 77 К протекает в изолированных пáрах «e–h», причём константа скорости рекомбинации зависит от
расстояния R между реагирующими частицами в паре kрек = n × exp(–R/a), где константы
n = 2,5 × 1015 с–1, а = 1,2 Å. За время от 2 × 10–7 до 1,2 × 10–6 с погибло 3,6 × 1015 пар. Определите
расстояние между реагентами в паре, считая его постоянным для всех пар, если
энергия излучения, затрачиваемая на создание одной электронно-дырочной пары,
равна 5 эВ.
2.7.5. Получите уравнение кинетической кривой для
реакции туннельного переноса электрона
D + A ¾® D+ + A–
в
твердом растворе, если функция распределения пар реагентов по расстоянию между
реагентами
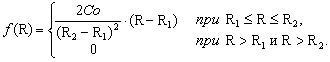
Вероятность
туннелирования электрона в единицу времени на
расстояние R известна: ![]() .
.