4. катализ и реакции на поверхности
4.4. Реакции на поверхности
4.4.1.
Титрование кислорода, адсорбированного на металле,
водородом идёт по схеме
H2 (газ) ![]() 2 H,
2 H,
O + 2 H ![]() H2O (газ).
H2O (газ).
Молекулы газовой фазы отмечены индексом (газ),
остальные частицы адсорбированы. Кинетические уравнения, соответствующие
стадиям (1) и (2), имеют вид
![]() ,
,
![]()
где РН2 – давление
водорода, qt
= qO + qH – полное покрытие, k1 = 106 Па–1с–1;
k–1 = 104 c–1; k2 = 102 c–1.
Титрование проводится при РН2 = 10–6 Па.
В начальный момент времени qO = 0,9; qH = 0.
Найдите, за какое время покрытие поверхности
кислородом достигнет величины qО = 0,1.
4.4.2.
Один из
возможных механизмов окисления водорода на поверхности металла имеет вид
1)
Н2 (газ) ![]() 2 Н,
2 Н,
2) О2 (газ) ![]() 2 О,
2 О,
3) О + Н ![]() ОН,
ОН,
4) ОН + Н ![]() Н2О (газ).
Н2О (газ).
Молекулы газовой фазы отмечены индексом (газ),
остальные частицы адсорбированы. Кинетические уравнения, соответствующие
стадиям 1–4, имеют вид
![]() ,
,
![]() ,
,
![]()
где qt = qO
+ qH + qOH – полное покрытие поверхности адсорбированными
частицами; k1 = k2 = 106 Па–1с–1;
k–1 = 1 c–1; k3 = 104 c–1; k4 = 106 c–1;
PH2 и PO2 – давление
водорода и кислорода. Реакция проводится в стационарных условиях при избытке кислорода: PH2 <<
PO2 £ 10–5 Па. Найдите зависимость
скорости реакции от давлений водорода и кислорода.
4.4.3.
Титрование
кислорода, адсорбированного на поверхности металла, водородом идёт по схеме
H2
(газ) ![]() 2 Н,
2 Н,
О + Н ![]() ОН,
ОН,
ОН + Н ![]() Н2О (газ).
Н2О (газ).
Молекулы газовой фазы отмечены индексом (газ),
остальные частицы адсорбированы. Кинетические уравнения, соответствующие
стадиям (1)–(3), имеют вид
![]()
![]()
![]()
где РН2 – давление
водорода, qt
= qО + qН + qОН – полное покрытие, k1 = 106 Па–1с–1;
k–1 = 1 с–1; k3 = 104 c–1;
k4 = 106 с–1. Титрование проводится при
давлении РН2 = 10–6 Па. В начальный
момент времени qО
= 0,9; qH
= qOH = 0. Найдите, за какое время покрытие
поверхности кислородом достигнет величины qО = 0,1.
4.4.4.
Реакция АВ +
С ¾® А
+ ВС протекает по схеме
1)
(АВ)газ ![]() (AB),
(AB),
2)
Cгаз ![]() C,
C,
3) (AB) ![]() A + B,
A + B,
4) B + C ![]() (BC)газ,
(BC)газ,
5) A ![]() Aгаз.
Aгаз.
Молекулы газовой фазы отмечены индексом (газ), остальные частицы
адсорбированы. Стадия (5) протекает столь быстро, что частицы А на поверхности фактически отсутствуют.
В этом случае кинетические уравнения, описывающие реакцию, имеют вид
dqAB/dt = k1PAB(1
– qAB – qC – qB) – k–1qAB – k3qAB(1 – qAB – qC – qB),
dqC/dt = k2PC(1
–qAB
– qC
– qB)
– k–2qC – k4qBqC,
dqB/dt = k3qAB(1 – qAB – qC – qB) – k4qBqC,
где Р – давление, q – степень покрытия поверхности. Предполагая,
что реакция происходит стационарно и реализуются соотношения k1PAB << k–1;
k2PC << k–2; k3 << k–1
и k4 << k–2, определите при каком условии
степень покрытия поверхности частицами В
(т. е. qВ)
будет близка к единице.
4.4.5. Поверхность
платины насыщена СО (qСО = 0,5; теплота
адсорбции СО равна 20 ккал/моль). Сколько времени система должна
находиться в вакууме, чтобы qСО стало меньше 0,1? Процессы реадсорбции во внимание не принимать.
4.4.6.
Под действием рентгеновского излучения в атмосфере
кислорода на поверхности твердого тела образуются короткоживущие активные
центры А* хемосорбции кислорода
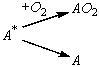
Считая, что хемосорбция при Т = 500 °С протекает
по механизму Или – Ридила с коэффициентом прилипания e » 10–1, определите зависимость
начальной скорости хемосорбции Wхем от давления кислорода РО2
и оцените значения Wхем при РО2 =
100 торр и 10–6 торр. Время жизни активных центров 10–3 с,
скорость их образования 3 × 1010 см–2с–1.
Состояние А неактивно в процессе
хемосорбции.