4. катализ и реакции на поверхности
4.5. Гетерогенный катализ
Стационарное состояние
4.5.22.
При исследовании реакции окисления СО на Pt было обнаружено, что
поверхность катализатора практически полностью покрыта окисью углерода. Для описания
механизма реакции была предложена следующая схема:
CO + Z ![]() COZ,
COZ,
O2 + Z ![]() O2Z,
O2Z,
O2Z + Z ![]()
OZ + COZ ![]() CO2 + 2 Z.
CO2 + 2 Z.
Теплота адсорбции СО оказалась
равной 100 кДж/моль, наблюдаемая энергия активации
реакции составляет 135 кДж/моль. Определите энергию активации адсорбции
кислорода (стадия 2).
4.5.22.
Углеводороды А
и В превращаются на одном и том же
гетерогенном катализаторе по одинаковому механизму:
1) Z + A ![]() ZA, 1)
Z + B
ZA, 1)
Z + B ![]() ZB
(равновесная),
ZB
(равновесная),
2) ZA ¾® P1 + Z, 2)
ZB ¾® P2 + Z,
3) ZA ¾® Z¢ 3) ZB ¾® Z¢ (дезактивация катализатора).
Относительные скорости превращения углеводородов А и В в раздельных
экспериментах (Wt/W0, где W0 и Wt – скорости превращения в момент времени t » 0 и t) уменьшаются во времени по закону Wt/W0 для А ~ exp(–at) и Wt/W0 для B ~ PBexp(–bPВt), где PВ – давление вещества В, a и b – константы. Установите, какой из
углеводородов адсорбируется прочнее.
4.5.23.
В стационарных условиях в реакторе идеального
смешения протекает каталитическая последовательная реакция окисления
![]()
по следующему механизму:
2 Z + O2 ![]() 2 ZO,
2 ZO,
ZO + A ![]() Z + B,
Z + B,
ZO + B ![]() Z + C.
Z + C.
Найдите значение скорости потока смеси, при котором будут наблюдаться
максимальная концентрация В на выходе
из реактора и максимальная селективность по продукту В в этой точке. Известно, что удельные константы скорости k2 = 10–4 cм/c, k3 = 10–2 cм/c,
загрузка катализатора составляет 0,1 г, удельная поверхность активного
компонента равна 104 см2/г катализатора. Входной
поток содержит только вещество А в
избытке кислорода. Условия проведения реакции таковы, что k1PO2 >> k2PA и k3PB.
4.5.24. Каталитическое
гидрирование 1-гексена на твердом пористом катализаторе в избытке Н2 протекает по 1-му порядку
с Еакт = 100 кДж/моль; Т = 500 К. С повышением температуры реакция переходит во внутридиффузионную, затем
– во внешнедиффузионную область. Как
изменится при этом Еакт и эффективный порядок реакции?
4.5.25.
В дифференциальном проточном реакторе (степень
превращения xA << 1) исследуется
гетерогенно-каталитическая реакция
А ¾® В
с одновременной дезактивацией катализатора (стадия 3). Реакция протекает по
следующему механизму:
1) Z + A ![]() ZA,
ZA,
2)
ZA ![]() Z + B,
Z + B,
3) ZA ![]() ZC,
ZC,
где А и В – газообразные реагенты; Z – адсорбционное место на поверхности катализатора; ZA, ZC – поверхностные соединения. Получите зависимость от времени степени
превращения А на выходе реактора, если известно, что k3 << k1PA, k2. В начальный момент времени степень превращения A составляла x0.
4.5.26.
(КР3–2007, №2). Для предполагаемого механизма
разложения закиси азота на пленках золота:
1) ![]() DH1
(равновесная)
DH1
(равновесная)
2) ![]() Е2
(лимитирующая)
Е2
(лимитирующая)
3) ![]() DH3 (равновесная)
DH3 (равновесная)
выразите наблюдаемую энергию активации реакции
через теплоты адсо-рбции DH1 и DH3 и энергию активации Е2, считая известными степени за-полнения поверхности
адсорбированными частицами: qN2O = 0,1, qО = 0,5.
4.5.27.
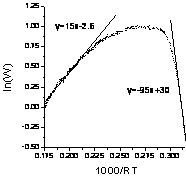
(КР3–2008, № 5). Кинетические закономерности окисления СО молекулярным кислородом на родии могут быть приближённо описаны
схемой Лэнгмюра-Хиншельвуда:
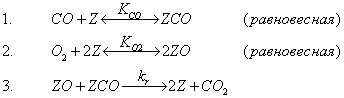
при следующих дополнительных условиях:
а) ![]() , причем
, причем ![]() не зависит от температуры;
не зависит от температуры;
б) при T < 450 К степень заполнения поверхности по СО близка к единице.
в) в диапазоне темпера-тур 550 K < Т < 700 K величина qCO << 1.
Используя приведённый на рисунке аррениусовский
график зависимости скорости окисления СО
от температуры, оцените теплоту адсорбции СО
и энергию активации стадии 3.