172. (1/2-07) Азот медленно пропускают через раствор 3 г нелетучего вещества в 200 г бензола, а затем через чистый бензол. Через некоторое время вес раствора уменьшился на 2,154 г, а чистый бензол потерял в весе 0,016 г. Чему равен молекулярный вес растворенного вещества?
173. (4/Э-04). Оцените, при какой температуре кипит раствор 1,45 г дихлоруксусной кислоты в 56,9 г четыреххлористого углерода?
А на самом деле точка кипения повышается на 0,52 K...
Чем, по-вашему, объясняется расхождение с экспериментом?
Tкип, ° С |
ΔНпл, кДж.моль–1 | М, г.моль–1 |
|
ССl4 |
76,6 | 29,8 | 153,8 |
С2HСl2OOH |
194 | 48,2 | 128,9 |
174. (3/Э-94). Температура кипения диметилового эфира при давлении 1,01 бар составляет 25,2 °С. При растворении 10,94 г некого нелетучего вещества в 100 г этого эфира давление пара эфира при 15,3 °С составило 0,598 бар. Вычислить молекулярную массу растворенного вещества, если известно, что теплота испарения чистого эфира составляет 17,28 кДж/моль.
175. (1/2-95). Изобразить качественно фазовые диаграммы “давление – состав” и “температура кипения – состав” для смеси бромбензола с водой, которые нерастворимы друг в друге. Указать, чему соответствует каждая из областей нарисованных диаграмм. Сколько воды потребуется для перегонки 100 г бромбензола с водяным паром при 1 атм и 368,3 К, если парциальное давление воды при этом составляет 0,852 атм.
176. (6/2-05). Какие из представленных ниже диаграмм “газ – жидкость” принципиально возможны, а какие нет? Еcли нет, то почему?

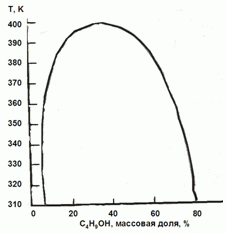 177. (3/2-08).
На основании фазовой диаграмма “жидкость – пар” для системы
H2O-C4H9OH оцените коэффициенты активности воды в сосуществующих
фазах при 350 К.
177. (3/2-08).
На основании фазовой диаграмма “жидкость – пар” для системы
H2O-C4H9OH оцените коэффициенты активности воды в сосуществующих
фазах при 350 К.
Каким будет давление пара воды над системой, содержащей 3 моля H2O и 2˚моля C4H9OH?
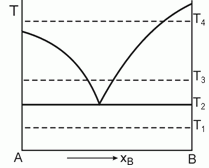 178. (2/Э-01).
Дайте интерпретацию приведен-ной диаграмме фазового равновесия, полученной при анализе смесей двух веществ А и В, являющихся жидкостями при температуре Т1.
178. (2/Э-01).
Дайте интерпретацию приведен-ной диаграмме фазового равновесия, полученной при анализе смесей двух веществ А и В, являющихся жидкостями при температуре Т1.
Постройте ожидаемые диаграммы фазового равновесия в координатах Р-x при температурах Т1, Т2, Т3 и Т4.
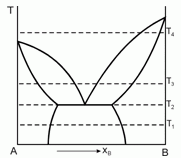 179. (5/2-97). Дайте интерпретацию приведен-ной диаграмме фазового равновесия, полученной при анализе смесей двух веществ А и В, являющихся жидкостями при температуре Т1. Постройте ожидаемые диаграммы фазового равновесия в координатах Р-Т при температурах Т1, Т2, Т3 и Т4.
179. (5/2-97). Дайте интерпретацию приведен-ной диаграмме фазового равновесия, полученной при анализе смесей двух веществ А и В, являющихся жидкостями при температуре Т1. Постройте ожидаемые диаграммы фазового равновесия в координатах Р-Т при температурах Т1, Т2, Т3 и Т4.
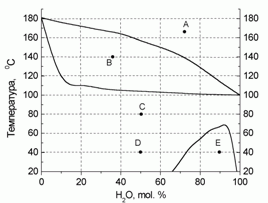 180. (4/2-05).* На рисунке приведена диаграмма состояния “температура – состав” для системы “вода – фе-нол” при давлении 760 торр. Определите, какие и какого состава фазы присутствуют в системе в точ-ках А – Е. Нарисуйте схематично диаграмму при P = 100 торр. Для воды D
испН = 40,66 кДж/моль (tкип = 100 оС).
180. (4/2-05).* На рисунке приведена диаграмма состояния “температура – состав” для системы “вода – фе-нол” при давлении 760 торр. Определите, какие и какого состава фазы присутствуют в системе в точ-ках А – Е. Нарисуйте схематично диаграмму при P = 100 торр. Для воды D
испН = 40,66 кДж/моль (tкип = 100 оС).
Для фенола D
испН = 47,97 кДж/моль (tкип = 181,9 оС).
Решение
181. (4/Э-05). Природа активного компонента Сu-Zn катализатора синтеза метанола вызывает много дискуссий. Одной из гипотез является образование Сu-Zn бронзы при обработке в восстановительной среде. Оценить равновесный состав металлических частиц катализатора Cu0/ZnO после их обработки в токе смеси 0,1 % H2O в водороде при атмосферном давлении и 500 К в предположении, что Сu-Zn бронза представляет собой идеальный раствор атомов цинка в металлической меди.
Процесс восстановления оксида цинка ZnO + H2 = Zn0 + H2O при 500 К характеризуется ΔrS0 = 57 Дж/(моль К) и ΔrH0 = 110 кДж/моль.