 193. (1/2-96). Диаграмма, описывающая равновесие "жидкость – тв.тело" (например, для смеси LiCl-NaCl), имеет вид, представленный на рисунке.
193. (1/2-96). Диаграмма, описывающая равновесие "жидкость – тв.тело" (например, для смеси LiCl-NaCl), имеет вид, представленный на рисунке.182. (6/2-95). Рассчитать изменение температуры замерзания воды, вызванное растворением воздуха в ней при 1 атм. (Воздух состоит из 79 % N2 и 21 % O2.) Константы Генри для О2 и N2 в воде при 273,2 К равны соответственно 2,51× 104 и 5,38× 104 атм. D НплН2О = 6029 Дж/моль.
183. (5/2-96). Определите формулу углеводорода на основании следующих данных: из 0,2 г вещества образуется 0,653 г СО2 и 0,320 г Н2О. Температура замерзания раствора, содержащего 0,09056 г вещества в 0,01 кг бензола, ниже Тпл. бензола на 0,354°. Ккриос. бензола = 5,16.
184. (6/Э-98). Раствор, содержащий 1,632 г трихлоруксусной кислоты в 100 г бензола, при охлаждении отвердевает на 0,350 °С ниже, чем чистый бензол. Определить, имеет ли место ассоциация или диссоциация кислоты и в какой степени, если теплота плавления чистого бензола равна 9,95 кДж/моль.
185. (4/2-04). При 50 оС приготовлен насыщенный раствор нафталина в бензоле. Оцените температуру, до которой следует охладить раствор для того, чтобы половина от использованного нафталина выпала в форме кристаллов. Энтальпия плавления нафталина при нормальной температуре его плавления (80.0 oC) равна 19,29 кДж . моль–1. Раствор можно считать идеальным.
186. (5/2-08) Энтальпия плавления нафталина при нормальной температуре его плавления (80,0 oC) равна 19,29 кДж/моль. При температуре 20 ° С проводится эксперимент по приготовлению насыщенного раствора нафталина в гексане. Будет ли получен насыщенный раствор при добавлении 0,48 моля нафталина к 0,72 моля гексана? Какова вариантность системы, включающей насыщенный раствор и равновесную с ним газовую фазу?
187. (3/2-02). К 15,401 г бензола, температура замерзания которого равна 5,400 °С, прибавлено 3,747 г раствора фосфора в бензоле, насыщенного при 18 °С. Точка отвержения полученной смеси оказалась равной 5,155 °С. Считая, что растворенная в бензоле молекула фосфора состоит из 4-х атомов, вычислить растворимость фосфора в бензоле при 18 °С, выразив ее в весовых процентах. Криоскопическая константа бензола равна 5°/моль. Атомная масса фосфора 31.
188. (3/П-94,99). Покажите, что незначительные загрязнения кристаллического вещества обычно приводят к понижению температуры его плавления. Как зависит это понижение от природы кристаллического вещества и примеси? Существуют ли исключения из сформулированного правила?
189. (1/2-97). Какие морозы еще не страшны для перевозки сухого вина на открытых машинах?
Известно, что для воды Δ
испHo = 44 кДж/моль, Δ
плНо = 6 кДж/моль.
190. (3/Э-07). После нагревания смеси 9 молей Cd и 1 моля Bi до некоторой температуры 4,5 моль Сd остались в твердом состоянии, а висмут расплавился полностью. Определите эту температуру, если известно, что компоненты не образуют твердых растворов (растворимость Bi в твердом Cd вблизи Тэвт = 0,03 %). Δ плHCd = 6,23 кДж/моль, tпл Cd = 321,1 ° С, Δ плHBi = 10,9 кДж/моль, tпл Bi = 271,3 ° С.
191. (5/Э-94). Вывести правило рычага для фазовых диаграмм "расплав – твердая фаза".
192. (5/2-98). Двухкомпонентные системы NaCl-AgCl и KCl-AgCl характеризуются неограниченной растворимостью компонентов друг в друге как в жидком, так и твердом состоянии.
tпл AgCl = 456 °С, tпл NaCl = 800 °С,
tпл KCl = 339 °С. Однако смесь KCl-AgCl имеет точку эвтектики,
а смесь NaCl-AgCl – нет.
Построить схематично обе диаграммы в координатах Т-х и оценить
положение точки эвтектики. ΔплНAgCl = 12,7 кДж/моль,
ΔплНКCl = 12,82 кДж/моль.
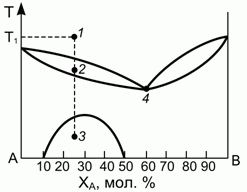
 193. (1/2-96). Диаграмма, описывающая равновесие "жидкость – тв.тело" (например, для смеси LiCl-NaCl), имеет вид, представленный на рисунке.
193. (1/2-96). Диаграмма, описывающая равновесие "жидкость – тв.тело" (например, для смеси LiCl-NaCl), имеет вид, представленный на рисунке.
Определить, какие, сколько и какого состава фазы присутствуют в системе в точках 1, 2, 3, 4, если при температуре Т1 было расплавлено 15 молей смеси.
Подсчитать число независимых термодинамических переменных в точках 3 и 4.
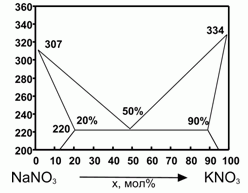 194. (6/2-00). Фазовая диаграмма плавкости
KNO3 – NaNO3 представлена на рисунке.
194. (6/2-00). Фазовая диаграмма плавкости
KNO3 – NaNO3 представлена на рисунке.
Δ Нпл (NaNO3) = 16 кДж/моль; Δ
Нпл (KNO3) = 11,7 кДж/моль; 1 моль механической смеси нитратов К и Na в мольном соотношении 1:1 расплавили и остудили до затвердевания и вновь расплавили. Оценить теплоту плавления смеси при повторном плавлении. Для оценки считать, что теплоемкость нитратов в жидком и твердом состоянии одинаковы, а все растворы - регулярны.
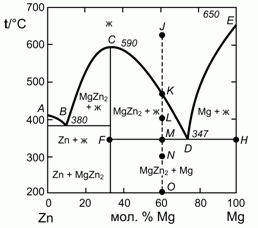 195. (1/2-96). 0,60 моля Mg и 0,40 моля Zn нагрели до 650 °C (точка J на фазовой диаграмме плавкости системы цинк – магний, изображенной на рисунке). Опишите, что будет происходить с этой системой при ее охлаждении до 200 °C (точка О). Каково состояние системы в точках K, L, М и О, а также составы и отношения количества соответствующих фаз?
195. (1/2-96). 0,60 моля Mg и 0,40 моля Zn нагрели до 650 °C (точка J на фазовой диаграмме плавкости системы цинк – магний, изображенной на рисунке). Опишите, что будет происходить с этой системой при ее охлаждении до 200 °C (точка О). Каково состояние системы в точках K, L, М и О, а также составы и отношения количества соответствующих фаз?
 196. (6/2-99). Для фигуративной точки О на диаграмме плавкости бинарной системы с неконгруентным плавлением найти мольную долю вещества, находящегося в разных фазах системы, а также мольные доли компонентов в разных фазах. Ответ пояснить.
196. (6/2-99). Для фигуративной точки О на диаграмме плавкости бинарной системы с неконгруентным плавлением найти мольную долю вещества, находящегося в разных фазах системы, а также мольные доли компонентов в разных фазах. Ответ пояснить.
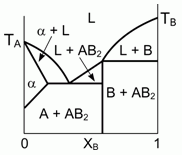 197. (6/2-03). Представленная на рисунке фазовая диаграмма, описывающая особенности
кристаллизации двухкомпонентной жидкости (здесь L-жидкость), не соответствует физико-химическим реалиям.
197. (6/2-03). Представленная на рисунке фазовая диаграмма, описывающая особенности
кристаллизации двухкомпонентной жидкости (здесь L-жидкость), не соответствует физико-химическим реалиям.
Исправьте ошибку. Что представляет собой фаза a ?
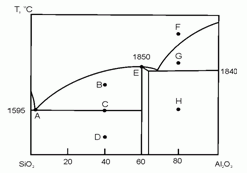 198. (4/Э-06). На рисунке схематично представлена фазовая диаграмма плавления системы оксид кремния – оксид алюминия.
198. (4/Э-06). На рисунке схематично представлена фазовая диаграмма плавления системы оксид кремния – оксид алюминия.
Опишите фазовый состав системы в точках А – H, отмеченных на диаграмме.
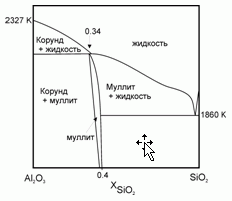 199. (5/Э-05).Плавление муллита 2Al2O3*SiO2 протекает с образованием твердого корунда α-Al2O3 и расплава, близкого по своему составу к муллиту. Известны температура плавления корунда Тпл (α-Al2O3) = 2327 K и теплота его плавления Δ
Hпл (α-Al2O3) = 111 кДж/моль. Полагая, что расплав SiO2–Al2O3 – идеальный раствор, оцените температуру плавления муллита.
199. (5/Э-05).Плавление муллита 2Al2O3*SiO2 протекает с образованием твердого корунда α-Al2O3 и расплава, близкого по своему составу к муллиту. Известны температура плавления корунда Тпл (α-Al2O3) = 2327 K и теплота его плавления Δ
Hпл (α-Al2O3) = 111 кДж/моль. Полагая, что расплав SiO2–Al2O3 – идеальный раствор, оцените температуру плавления муллита.
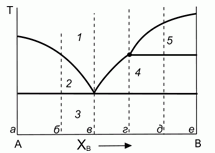 200. (7/Э-00). Некоторая бинарная система с неконгруентным плавлением характеризуется следующей диаграммой плавкости.
200. (7/Э-00). Некоторая бинарная система с неконгруентным плавлением характеризуется следующей диаграммой плавкости.
Дайте качественное пояснение данной диаграмме и природе ее отдельных участков "1"–"5". Нарисуйте качественно вид интегральных и дифференциальных кривых остывания при термическом анализе системы для конкретных составов в точках "а"– "е".
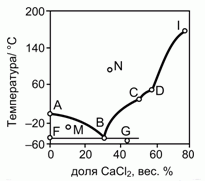 201. (4/2-02). На рисунке приведена фазовая диаграмма плавкости для бинарной системы "вода – CaCl2".
201. (4/2-02). На рисунке приведена фазовая диаграмма плавкости для бинарной системы "вода – CaCl2".
Опишите особенности состава системы в точках A, B, C, D, F, G, I, M и N.
Как называются отмеченные точки B, C, D ?
Молекулярная масса CaCl2 – 111.
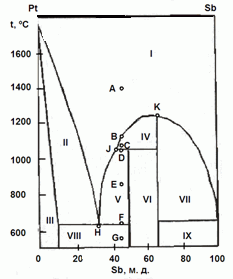 202. (6/2-08).На рисунке приведена фазовая диаграмма
плавкости для бинарной системы "Pt – Sb".
202. (6/2-08).На рисунке приведена фазовая диаграмма
плавкости для бинарной системы "Pt – Sb".
Назовите равновесные фазы и укажите их число в областях I – IX.
Опишите, что будет происходить с системой при охлаждении расплава с содержанием Sb 45 % от 1400 ºС (точка А) до 550 ºС (точка G).
Каково состояние системы в точках B, C, D, E, F? Как называются точки Н, J, K?
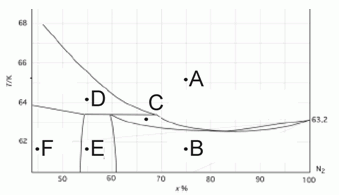 203. (5/2-07).* На рисунке представлена фазовая диаграмма T(x) для бинарной системы "Ar – N2" в области фазовых переходов твердое – жидкость (T указана в К).
203. (5/2-07).* На рисунке представлена фазовая диаграмма T(x) для бинарной системы "Ar – N2" в области фазовых переходов твердое – жидкость (T указана в К).
Опишите фазовый состав в точках А–F.
(по данным: Long H. M., Di Paolo F. S., 1963, Chem. Eng. Prog. Symp. Ser., Vol. 59, p. 30–35).
204. (6/2-06). Чугуном называется сплав железа с углеродом, в котором содержание углерода превышает 2,14 мас. %. При выплавке стали, уменьшения содержания углерода в расплаве достигают окислением его кислородом воздуха. Какого содержания углерода в стали могли достигать в мартеновских печах в 19 веке, если удавалось поддерживать температуру расплава 1450 ° С?
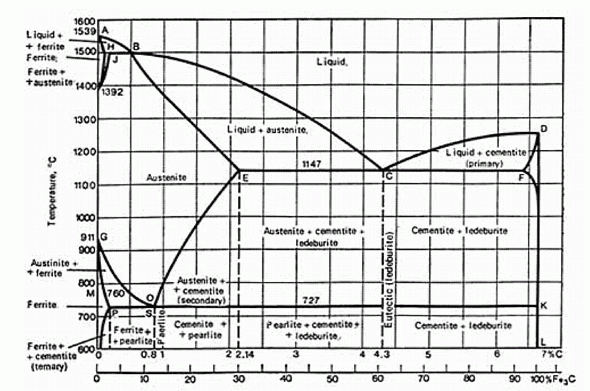
Ferrite (феррит) – α-Fe0; Austenite (аустенит) – γ-Fe0; Cementite (цементит) – Fe3C; Ledeburite (ледебурит) и pearlite (перлит) – названия, принятые для композитных структурных составляющих гетерогенных твердых систем Fe-C, соответствующих на диаграмме эвтектике "С" и эвтектоиду "O".
205. (6/Э-08). Существование в системе "уран – ртуть" трех кристаллических соединений (UHg2, UHg3 и UHg4) было установлено Рэндлом и Вилсоном (Acta Crystallogr. 1949. Vol.3. P. 148–150). Используя данные таблицы, постройте Т-х диаграмму в диапазоне температур 250 – 400 К). Известно, что Тпл урана 1403 К, Тпл ртути 234 К, твердые растворы в системе не образуются. Также известны термодинамические характеристики реакций образования соединений U-Hg из a -урана и жидкой ртути
Соединение |
ΔfH, кДж/моль |
ΔS, Дж/моль*K |
UHg2 |
– 52,72 |
– 37,57 |
UHg3 |
– 63,55 |
– 46,73 |
UHg4 |
– 78,01 |
– 66,40 |
206. (5/3-94). Образование газовых гидратов метана [CH4× 6H2O], представляющих собой термодинамически нестойкие твердые вещества, соответствует уравнению
CH4 + 6H2O = [CH4× 6H2O].
Изобразите качественно диаграмму состояния (фазовую диаграмму) для процесса гидратообразования в координатах "общее давление –температура" (диаграмма Розебома – Штакельберга). Области с сосуществованием твердой фазы метана и газообразной воды можно не рассматривать. Считать, что метан и вода взаимно не растворяются друг в друге. Учесть, что плотность гидрата метана меньше плотности жидкой воды.