216. (1/3-99). Давление HCl над 4 %-м (вес) водным раствором HCl при 25 °С равно 4,4× 10–4 торр. Пользуясь законом Дебая – Хюккеля для предельно разбавленного раствора, оценить давление HCl над 2 %-м (вес) раствором HCl. Молекулярная масса HCl – 36,5.
217. (3/3-94).* В воде растворено некоторое количество нелетучего слабого электролита, не диссоциирующего при низкой температуре, но полностью диссоциирующего на два иона при температурах, близких к температуре кипения воды. Найти температуру кипения данного раствора, если известно, что этот же раствор замерзает при 271,5 К. Учесть, что для чистой воды Δ
Нпл = 6,029 кДж/моль, Тпл = 273,15 К, Δ
Нисп = 40,62 кДж/моль, Ткип = 373,15 К.
Определить давление паров воды над раствором при 299 К, если над чистой водой при 298 К оно
равно 0,03168 бар.
Решение
218. (3/3-00). Равновесное давление H2SO4 над 4 %-м (вес.) водным раствором H2SO4 равно 10–5 торр. Пользуясь соотношениями Дебая – Хюккеля для предельно разбавленного раствора, оценить давление H2SO4 над 2 %-м (вес.) раствором H2SO4. Молекулярная масса H2SO4 98 г.
219. (1/3-03). Константа диссоциации уксусной кислоты в водном растворе при 25 °С равна 1,75 × 10–5 М. Используя первое приближение теории Дебая – Хюккеля, рассчитайте степень диссоциации кислоты, если ее моляльность равна 0,100 моль × кг–1.
Что будет со степенью диссоциации кислоты, если в раствор дополнительно добавят 1 М NaCl?
220. (4/3-01). Среднеионный коэффициент активности растворенной соли АВ дается уравнением
lg g± = –С
где m – моляльность раствора. Выразите коэффициент активности g 1 растворителя через С, D и m. Считать мольную массу растворителя М1, катиона соли МА, а аниона – МВ.
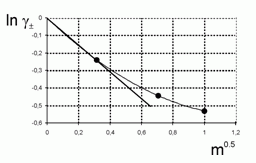
221. (5/Э-06).
Известно, что при температуре 0 ºС среднеионный коэффициент активности
Оценить коэффициент активности воды при m = 0,1 моль / кгводы, исходя из следующих экспериментальных данных:
|
|
0,316 |
0,707 |
1 |
|
|
–0,241 |
–0,443 |
–0,531 |
222. (1/3-06). В 100 см3 раствора HCl с концентрацией 10–3 М растворили 10–3 моль NaCl. Оцените, как изменился рН раствора.
223. (1/3-02). В 1 литр водного раствора легкорастворимого ацетата кальция концентрацией 0,1 М добавили 0,1 моль сульфата калия. Оцените рН полученного раствора, пользуясь следующими термодинамическими данными:
CH3COOH = CH3COO– + H+; Ka = 1,75× 10–5 M;
CaSO4 = Ca2+ + SO42–; ПР = 1,7× 10–5 M2.