248. (1/3-00). Равновесный микрокристалл некоторого вещества имеет форму параллелепипеда объемом Vо. Поверхностное натяжение на гранях микрокристалла равно для разных граней s a, s b, s c. Определить длины сторон кристалла для значений s a = 1, s b = 2, s c = 3 Дж/м2; V0 = 10–3 мм3.
249. (6/Э-96). Выведите формулу Томсона (Кельвина) для давления насыщенных паров над капелькой жидкости радиусом r. Какова будет разница в результатах расчета при учете и неучете зависимости химического потенциала жидкости от лапласова (“капиллярного”) давления внутри капли. Какой вариант расчета следует считать корректным?
250. (3/3-05). Растворимость озона в воде при 20 оС составляет 0,688 г/(л атм). Оценить равновесную концентрацию озона в воде, которую озонируют потоком газовой смеси, содержащей 0,1 % озона, с диаметром пузырьков газа 50 мкм. Коэффициент поверхностного натяжения воды составляет 0,071 Н/м.
251. (2/3-02). Пористый материал был пропитан водой так, чтобы заполнить все поры, а затем заморожен в жидком азоте. Оцените минимальный и максимальный размер пор, если при нагревании материала начало плавления льда в порах было зарегистрировано при –20 °С, а при –10 °С весь лед уже расплавился. Процесс плавления считать равновесным. Коэффициент поверхностного натяжения льда s = 0,07 Дж/м2, D плНо = 6 кДж/моль, плотность льда r = 900 кг/м3.

252. (5/3-07).11 Известно, что пары воды иногда конденсируются в виде дисперсных лучистых кристаллов – снежинок. Характерная масса одной снежинки составляет 1 мг, а поверхность тех пушистых снежинок, которые выпадают в условиях нашего климата, – 10–4 м2.
Оценить изменение температуры плавления свежего пушистого снега по сравнению с массивным льдом.
Известно, что:

253. (3/3-08).* Суспензия серы в воде была исследована методом термического анализа. Суспензию нагрева11ли до температуры 200 оС в ячейках-автоклавах со скоростью нагрева около 1 К/мин, при этом растворения серы в воде не наблюдалось. Используя приведенную на рисунке кривую ДТА, оцените минимальный размер частиц серы.
Коэффициент поверхностного натяжения для серы σ = 0,042 Дж/м2 , ρS = 2,07 г/см3.
Фазовый переход |
ΔфпH0.,кДж/моль |
Тфп, 0С |
S (ромб) ® S (монокл) |
0,36 |
95,6 |
S (монокл) ® S (ж) |
1,26 |
119,3 |
H2O (ж) ® H2O (п) |
40,4 |
100 |
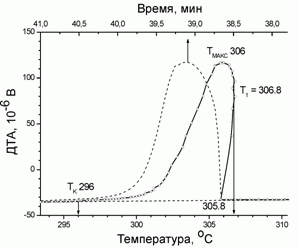
254. (5/Э-08).11 На рисунке приведен фрагмент термической кривой ДТА охлаждения NaNO3, содержащий эффект кристаллизации соли из расплава. Пунктиром отмечена зависимость сигнала ДТА от времени (верхняя ось абсцисс). Скорость охлаждения – 5 К/мин. Оцените размер первичных зародышей твердой фазы, если известно, что теплота плавления NaNO3 составляет 16 кДж/моль, а коэффициент поверхностного натяжения для тв. NaNO3 в контакте с расплавом можно полагать равным 0,35 Дж/м2. Плотность NaNO3 = 2,26 г/см3, молярная масса 85 г/моль.
255. (1/3-04). При какой температуре начнётся процесс конденсации воды из водяного пара при его давлении 1 атм, если образуются капельки воды размером 100 Å. s = 0,0728 Дж/м2, D Hисп = 40,66 кДж/моль?
256. (4/3-04). Известно, что наиболее частой причиной “перегорания” лампы накаливания является истоньшение нити до ее плавления. Оцените минимально возможную толщину вольфрамовой нити в лампе накаливания, если ее температура составляет 3000 К. Удельная теплота плавления вольфрама составляет 191 кДж/кг, температура плавления – 3416 К, плотность при 3000 К ρ = 18,6 г/см3, атомный вес MW = 183,86. Избыточную поверхностную энергию вольфрама считать равной 4 Дж/м2.
257. (5/Э-95). Найти, при каком давлении могут сосуществовать при комнатной температуре и при 500 °С массивные фазы двух модификаций TiO2 – рутила и анатаза, если известно, что
|
|
ρ, г/см3 |
Ср 298, Дж/(моль.К) |
|
рутил |
–934,9 |
50,33 |
4,2 |
55,02 |
анатаз |
–938,6 |
49,98 |
3,7 |
55,48 |
Как изменятся результаты расчета при сильном диспергировании вещества оксида? Температура плавления обоих оксидов примерно одинакова и равна 1870 °С.
258. (4/2-95). Температура равновесного существования белой (1) и серой (2) модификаций олова при атмосферном давлении равна 14 °С, плотности – r 1 = 7,29 г/см3 и r 2 = 5,85 г/см3. Теплота превращения белого олова в серое +2 кДж/моль. Температура плавления серого олова при атмосферном давлении 231,9 °С. Оценить, при каком давлении может происходить самопроизвольный переход (1) в (2) при температуре 300 °С для случая а) массивных кристаллических образцов и б) дисперсных частиц размером 100 нм. Поверхностное натяжение s принять равным 1 Дж/м2.
259. (5/3-95). Какие давления нужны для получения алмаза из графита при комнатной температуре в случае синтеза ультрадисперсных (d < 100 Å) алмазов, если s (углерод/газ) » 0,1 Дж/м2?
|
|
|
ρ г/см3 |
Ср 298, Дж/(моль.К) |
|
С (графит) |
0 |
5,74 |
2,265 |
8,54 |
С (алмаз) |
–1,828 |
2,368 |
3,515 |
6,117 |
260. (3/2-98). Растворимость крупных кристаллов ацетилсалициловой кислоты (аспирина) в воде при 25 °С составляет 3 г в 300 г воды. Оцените равновесную концентрацию раствора тонко измельченного аспирина, если средний размер его кристаллов равен 3х10–6 см. Мольный объем аспирина – 155 см3, молекулярная масса аспирина – 180. Поверхностное натяжение на фазовой границе кристалл-раствор примите равным 0.5 Дж/м2.
261. (2/3-01). Оцените равновесную концентрацию ионов бария над мелко измельченным порошком BaSO4 при 25 °С, если средний размер (диаметр) его кристаллов составляет 0,1 мкм. Известно, что плотность кристаллического сульфата бария 4,5 г/см3, Mr(BaSO4) = 233,4 г/моль, ПР(BaSO4) = 10–10 М2, а коэффициент поверхностного натяжения на границе кристалл-раствор равен 0,2 Дж/м2.
262. (3/3-03). Найти выражение для закона Генри при растворении газа в каплях жидкости с
поверхностным натяжением s
и радиусом r. Во сколько раз меняется растворимость газа с парциальным мольным объемом
растворенного газа
сравнению с растворимостью в ртути с плоской поверхностью раздела? Для ртути s = 465 × 10–3 Дж / м2.
263. (6/2-96). Можно ли подобрать условия для растворения "рассеянного" (до частиц диаметром 40 Å) в породе золота цианистой кислотой с переводом его в цианидный комплекс? Изменится ли результат, если золото будет в виде металлического куска. Ответ подтвердите оценочными расчетами. Допускается варьирование концентраций всех компонентов и парциального давления водорода в разумных пределах.
Eo[Au(CN)2]–/Au = –0,61 B отн. Н.В.Э., KaHCN = 8× 10–10; r Au = 19,3 г/cм3; s Au = 2H/м. Молекулярный вес золота 197.
264. (7/П-05). Природа активного компонента Сu-Zn катализатора синтеза метанола вызывает много дискуссий. Одной из гипотез является образование Сu-Zn бронзы при обработке в восстановительной среде. Оценить равновесный состав поверхности Cu-Zn сплава с мольным содержанием Zn 3.10–4 % при температуре 500 К, если известно, что значения избыточной поверхностной энергии для металлических меди и цинка равны соответственно: σСu = 1,3 Дж/м2 а σZn = 0,67 Дж/м2. Сплав меди и цинка полагать идеальным. Концентрация атомов металлов на поверхности сплава равна 1,5 1019 ат..м–2.
Рекомендация. Рассматривайте изменение потенциала Гиббса в процессе миграции Zn из объема сплава на его поверхность.
265. (6/Э-04). В одном зимнем приморском городе установилась морозная и довольно "сухая" погода –10 оС, а влажность воздуха, выраженная в парциальном давлении паров воды, составила 1,9 торр. Как уже всем известно (см. задачу 118. (2/2-04)), в таких условиях даже можно высушить бельё.
Удастся ли высушить в такую прекрасную погоду пуховое одеяло с характерным размером между ворсинками пуха около 1 мкм?
Как и прежде, известно, что: а) белье всегда "замерзает" при указанной температуре (и пух тоже); б) изменение энергии Гиббса для процесса: Н2О (ж., –10 оС) ®
Н2О (тв., –10 оС) составляет
–212,4 Дж/моль; в) при –10 оС равновесное давление насыщенных паров над жидкой водой равно 2,149 торр. Кроме того, известно, что: г) вода смачивает пух; д) плотность льда составляет 0,917 г/см3, а его удельная поверхностная энергия около 0,07 Дж/м2.
266. (5/Э-98). Упругость водяного пара в атмосфере тумана, состоящего из капель диаметром 10 микрон, при 12 °С равна 10,520 мм. рт. ст. Если же туман состоит из капель 0,1 микрон, то при той же температуре упругость водяного пара над такими же каплями равна 10,718 торр. Оценить поверхностное натяжение воды.
267. (4/3-06). Найдите зависимость концентрации растворенных ионов железа
Fe2O3 тв + 6H+ ↔ 2Fe3+ + 3H2Oж .
Какова концентрация
Вещество |
|
|
|
|
|
–743,3 |
0 |
15,73 |
–237,15 |
268. (4/3-07).* Железную деталь покрывают краской, состоящей из порошка кадмия. Возможно ли приготовить краску из такого ультрадисперсного порошка кадмия, при использовании которого не будет происходить коррозионного разрушения детали во влажной среде в присутствии кислорода? E0(Cd2+/Cd) = – 0,403 В, E0(Fe2+/Fe) = – 0,447 В отн. Н.В.Э., ρCd = 8,65 г/см3, МCd = 112,41 г/моль, σCd ≈ 0,8 Дж/м2.
Примечание. Коррозия происходит из-за протекания двух полуреакций – анодной Me à
Men++ ne– и катодной
O2 + 4H+ + 4e– → 2H2O (E0 = 1,23 В отн. НВЭ).
269. (6/3-06). Способ получения чистой меди из руды с примесями серебра заключается в следующем. Пирометаллургическую медь, представляющую собой сплав из 1 т меди и 7 кг серебра, помещают в качестве анода в водный раствор 1 М CuSO4, а катодом служат листы чистой меди. На электроды подают напряжение 0.23 В при 25 ºС, при этом происходит окисление металлической меди анода, переход Cu2+ в раствор и восстановление Cu2+ на катоде. Серебро, имеющее более высокий потенциал, чем медь, остается в металлическом виде, и при растворении анода выпадает в виде шлама на дно электролитической ванны.
Определите КПД выделения 1 моля чистой меди (отношение полезной работы термодинамического равновесия к затраченной электрической работе) при таком способе получения, считая сплав анода идеальным твердым раствором. Образованием Cu+, а также реакциями с участием O2 в растворе пренебречь. Как изменится оценка КПД, если учесть, что электролитическая медь имеет развитую поверхность около 1 м2/г, а σCu = 1.3 Дж/м2?
Что будет происходить, если на электроды перестать подавать напряжение?
Стандартный электродный потенциал меди