309. (5/3-08). Природное содержание изотопа 18О составляет 0,2 %. Известно, что мольная доля молекул озона O3 с молекулярной массой 50 составляет 6.10–3, а с молекулярной массой 52 – 1,2.10–5. Можно ли из этих данных сделать вывод о симметрии молекул озона?
310. (5/3-03). Оценить количество CD3H в системе после установления полного термодинамического равновесия, если исходно в систему ввели 1 моль СD4 и 2 моля Н2.
311. (5/Э-04).* Природное содержание изотопа 13С составляет 1,12 % всего углерода, а дейтерия 2Н – 1,6.10–4 всего водорода. Определить минимальную работу, необходимую для выделения 1 моля "сверхтяжелого" метана 13СD4 в изобарном процессе при 300 К, предполагается, что чистый метан доступен в неограниченных количествах.
Решение312. (6/Э-06). 2 моля равновесной смеси частично дейтерированного метана, содержащей атомы D и Н в соотношении 3:1, смешивают с 1 молем чистого метана СН4 при 298 К и давлении 1 атм. Определите изменение энтропии системы в этом процессе до установления полного равновесия, предполагая, что ΔH0298 реакций изотопного обмена равны нулю.
313. (4/Э1-94,99). Определите изменение энтропии, вызванное в одном моле HDO исчерпывающе полным дейтерообменом по реакции
HDO + D2 = D2O + HD.
314. (1/3-96). Найти изменение энтропии (после установления полного термодинамического равновесия) при смешении трех жидких компонентов: 1 моля Н2О, 1 моля D2О и 2 молей растворителя, не содержащего обменивающихся атомов водорода. Для простоты массы протия и дейтерия можно считать одинаковыми.
315. (3/Э-00). Образец изотопно-меченой воды приготовили добавлением 110 г D218O к 900 г Н216О. Определить число линейно независимых реакций изотопного обмена и рассчитать равновесный состав смеси, полагая энергетическую эквивалентность всех изотопомеров. Найти энтропию смешения при получении данной смеси.
316. (6/Э-01). Найти равновесный состав системы, первоначально содержавшей 8 молей CH3OH и 4 моля D2O. Считать, что в условиях нахождения системы протоны –CH3-группы не подвержены изотопному обмену. Влиянием изотопного состава на энергетические характеристики молекул и вращением молекул можно пренебречь. Как изменится результат при учете внутренних вращений в молекуле метанола?
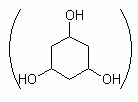
317. (5/3-05). Рассчитать равновесный состав в смеси дейтерозамещенного флюроглицина, если замещение H на D происходит только в ОН-группах, а мольные доли атомов H и D в смеси соответственно равны 0,3 и 0,7.
318. (3/3-01). К 1 молю нафталина, находящемуся в газовой фазе при давлении 10 Па и температуре 400 К, добавили 4 моля молекулярного дейтерия. Найдите, какое количество молекулярного протия будет находиться в газовой фазе после завершения реакции изотопного обмена при той же температуре, если различием в энергетике дейтерированных и обычных соединений, а также вкладом поступательных степеней свободы можно пренебречь.
319. (3/Э-98). Молярные доли стабильных изотопов 13С и 2Н в природных образцах углерода и водорода равны 1,12× 10–2 и 1,6× 10–4 соответственно. Определите минимальную работу по выделению 1 моля газообразного "сверхтяжелого метана" 13С(2Н)4 в изобарном процессе, приводимом при Т = 300 К. Исходным сырьем служит природный газ с содержанием метана 65 мол. %, доступный в неограниченных количествах.
320. (6/3-00). Система представляет собой сосуд с перегородкой, в одной половине которого находится 8,5 г NH3 при –50 °С, а в другой 10 г ND3 при той же температуре. Найти изменение энтропии системы при установлении полного равновесия после удаления перегородки. Считать, что смешение происходит изотермически.