Первое начало термодинамики, термохимия
Изолированные, открытые и закрытые системы, классический и статистический подходы к описанию термодинамических систем. Интенсивные и экстенсивные параметры состояния
системы. Теплота. Работа. Внутренняя энергия. Первое начало термодинамики. Уравнения состояния. Функции состояния. Закон Гесса. Стандартные состояния.
Энтропия. Второе и третье начала термодинамики
Состояние системы и микросостояния системы, степень вырождения, допустимые микросостояния. Эргодическая гипотеза. Энтропия. Температура. Связь внутренней
энергии, энтропии и температуры. Теплоемкость. Свойства энтропии. Второе начало термодинамики. Обратимые и необратимые процессы. Третье начало термодинамики.
Термодинамические потенциалы
Характеристические функции. Термодинамические потенциалы - внутренняя энергия, энтальпия, потенциал Гельмгольца, потенциал Гиббса.
Фундаментальные уравнения и термодинамические соотношения между термодинамическими величинами. Уравнения Максвелла. Уравнение Гиббса - Гельмгольца.
(Необходимый математический аппарат - Якобиан. Алгебраические соотношения для детерминантов матриц Якоби второго ранга.)
1. (1/1-99). Какие из перечисленных ниже функций являются функциями состояния, а какие - термодинамическими
потенциалами?
Н + PV,
H
2
+5PV
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaWaaSaaaeaacaWGibaabaGaaGOmaaaacqGHRaWkcaaI1aGaamiuaiaadAfaaaa@3AD7@
,
G
S
+10TS
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaWaaSaaaeaacaWGhbaabaGaam4uaaaacqGHRaWkcaaIXaGaaGimaiaadsfacaWGtbaaaa@3BA9@
, A + PV ,
A
PV
+
T
V
S
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaWaaSaaaeaacaWGbbaabaGaamiuaiaadAfaaaGaey4kaSYaaSaaaeaacaWGubaabaGaamOvaaaacaWGtbaaaa@3BF1@
.
Почему? Напишите фундаментальные уравнения для термодинамических потенциалов.
2. (1/Э-96), (1/Э-98). Вывести выражение для изобарно-изотермического потенциала
через термодинамические параметры и параметры статистической физики.
3. (1/Э-01). Вывести выражения для
термодинамического потенциала Гиббса через термодинамические параметры и
параметры статистической термодинамики. Какими свойствами обладает потенциал
Гиббса и когда его используют?
4. (1/Э-97). Вывести выражения для
изохорно-изотермического потенциала через термодинамические параметры и через
параметры статистической физики.
5. (1/Э-00). Вывести соотношения Гиббса - Гельмгольца. В каких случаях
используют эти соотношения?
6. (1/Э-02). Вывести выражения для
термодинамического потенциала Гельмгольца, внутренней энергии и энтропии через
параметры статистической термодинамики. Какими свойствами обладает потенциал
Гельмгольца и когда его используют?
7. (1/1-95). Показать, что адиабатическое расширение идеального газа всегда
сопровождается его охлаждением.
8. (2/1-96). Доказать, что при адиабатическом процессе внутренняя энергия системы
является возрастающей функцией температуры.
9. (5/1-96). Термическое
и калорическое уравнения состояния идеального электронного газа связаны
соотношением PV = 2/3 U. Найти для этого газа уравнение
адиабаты в переменных P - V.
10. (1/Э-06).* Известно термическое уравнение состояния газа Ван-дер-Ваальса:
(P+
a
V
2
)(V−b)=RT.
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaaiikaiaadcfacqGHRaWkdaWcaaqaaiaadggaaeaacaWGwbWaaWbaaSqabeaacaaIYaaaaaaakiaacMcacaGGOaGaamOvaiabgkHiTiaadkgacaGGPaGaeyypa0JaamOuaiaadsfacaGGUaaaaa@4331@
Выведите калорическое уравнение состояния газа Ван-дер-Ваальса U = U (T,V)
Решение
11. (1/1-98). Для газа, подчиняющегося уравнению Ван-дер-Ваальса
P=
RT
V−b
−
a
V
2
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaamiuaiabg2da9maalaaabaGaamOuaiaadsfaaeaacaWGwbGaeyOeI0IaamOyaaaacqGHsisldaWcaaqaaiaadggaaeaacaWGwbWaaWbaaSqabeaacaaIYaaaaaaaaaa@3FDE@
,
справедливо соотношение
(
∂P
∂T
)
v
=
R
V−b
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaWaaeWaaeaadaWcaaqaaiabgkGi2kaadcfaaeaacqGHciITcaWGubaaaaGaayjkaiaawMcaamaaBaaaleaacaWG2baabeaakiabg2da9maalaaabaGaamOuaaqaaiaadAfacqGHsislcaWGIbaaaaaa@41CD@
.
Найдите для этого газа значения
(
∂U
∂V
)
T
,
(
∂
c
V
∂V
)
T
,
(
∂T
∂V
)
U
,
(
∂T
∂V
)
S
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaWaaeWaaeaadaWcaaqaaiabgkGi2kaadwfaaeaacqGHciITcaWGwbaaaaGaayjkaiaawMcaamaaBaaaleaacaWGubaabeaakiaacYcadaqadaqaamaalaaabaGaeyOaIyRaam4yamaaBaaaleaacaWGwbaabeaaaOqaaiabgkGi2kaadAfaaaaacaGLOaGaayzkaaWaaSbaaSqaaiaadsfaaeqaaOGaaiilaiaaykW7daqadaqaamaalaaabaGaeyOaIyRaamivaaqaaiabgkGi2kaadAfaaaaacaGLOaGaayzkaaWaaSbaaSqaaiaadwfaaeqaaOGaaiilaiaaykW7daqadaqaamaalaaabaGaeyOaIyRaamivaaqaaiabgkGi2kaadAfaaaaacaGLOaGaayzkaaWaaSbaaSqaaiaadofaaeqaaaaa@58CA@
.
Получите калорическое уравнения состояния газа Ван-дер-Ваальса, используя полученные соотношения.
12. (1/1-02). Найти
(
∂T
∂V
)
U
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaWaaeWaaeaadaWcaaqaaiabgkGi2kaadsfaaeaacqGHciITcaWGwbaaaaGaayjkaiaawMcaamaaBaaaleaacaWGvbaabeaaaaa@3D0C@
и
(
∂T
∂V
)
S
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaWaaeWaaeaadaWcaaqaaiabgkGi2kaadsfaaeaacqGHciITcaWGwbaaaaGaayjkaiaawMcaamaaBaaaleaacaWGtbaabeaaaaa@3D0A@
для газа Ван -дер-Ваальса с уравнением состояния
(
P+
a
V
2
)(
V−b
)=RT
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaWaaeWaaeaacaWGqbGaey4kaSYaaSaaaeaacaWGHbaabaGaamOvamaaCaaaleqabaGaaGOmaaaaaaaakiaawIcacaGLPaaadaqadaqaaiaadAfacqGHsislcaWGIbaacaGLOaGaayzkaaGaeyypa0JaamOuaiaadsfaaaa@42DF@
и известной теплоемкостью С V. Дать качественное пояснение особенности рассматриваемых процессов.
13. (3/Э1-94,99). В вакуумированном объеме с адиабатической оболочкой приводят в соприкосновение два твердых образца
одного вещества. Начальные температуры образцов различаются. Приняв количества вещества в образцах одинаковыми и теплоемкость вещества постоянной, определите
изменение энтропии при переходе системы к термическому равновесию. Как изменится ответ, если в объеме исходно находился также воздух?
14. (2/1-02). Система состоит из двух теплоизолированных колб, разделенных теплонепроницаемой перегородкой. Исходно в
каждой из колб находится по одному молю одного и того же идеального газа при одинаковом давлении р, но разной температуре: Т1 и Т2.
Найти изменение энтропии этой системы при удалении перегородки и достижении состояния термодинамического равновесия, если с v
этого газа не зависит от температуры.
15. (2/1-05). Определите отношение
W
ΔS
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaWaaSaaaeaacaWGxbaabaGaeuiLdqKaam4uaaaaaaa@3917@
, где W - работа, затрачиваемая на изотермическое сжатие одного моля идеального газа при T = 450 K от объема V 1 = 45
л до объема V2 = 24 л Δ S - - изменение энтропии газа в указанном процессе.
16. (1/Э-05).* Углекислый газ подчиняется уравнению состояния Ван-дер-Ваальса
(
P+
a
V
2
)(
V−b
)=RT
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaWaaeWaaeaacaWGqbGaey4kaSYaaSaaaeaacaWGHbaabaGaamOvamaaCaaaleqabaGaaGOmaaaaaaaakiaawIcacaGLPaaadaqadaqaaiaadAfacqGHsislcaWGIbaacaGLOaGaayzkaaGaeyypa0JaamOuaiaadsfaaaa@42DF@
с параметрами α= 0,364 Дж·м3.моль-2 и b = 4,27· 10 - 5
м3/моль. Оцените изменение внутренней энергии в процессе сжатия одного моля CO2 с объема V 1 = 10 л
до V 2 = 1 л, проводимом при 298 К.
Решение
17. (2/1-06).* Доказать соотношение:
(
∂T
∂V
)
U
=
P−
(
∂P
∂T
)
V
T
C
V
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaWaaeWaaeaadaWcaaqaaiabgkGi2kaadsfaaeaacqGHciITcaWGwbaaaaGaayjkaiaawMcaamaaBaaaleaacaWGvbaabeaakiabg2da9maalaaabaGaamiuaiabgkHiTmaabmaabaWaaSaaaeaacqGHciITcaWGqbaabaGaeyOaIyRaamivaaaaaiaawIcacaGLPaaadaWgaaWcbaGaamOvaaqabaGccaWGubaabaGaam4qamaaBaaaleaacaWGwbaabeaaaaaaaa@49BA@
. Как будет изменяться при адиабатическом расширении в вакуум температура неидеального газа c фактором сжимаемости
PV
RT
≡Z(V,T)
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaWaaSaaaeaacaWGqbGaamOvaaqaaiaadkfacaWGubaaaiabggMi6kaadQfacaGGOaGaamOvaiaacYcacaWGubGaaiykaaaa@3FC2@
?
Решение
18. (2/1-99). Уравнение состояния моля реального газа описывается соотношением P = RT/(V - b) - a/V2 c a > 0, b > 0
Как изменится температура этого газа при необратимом адиабатическом расширении газа в вакуум?
19. (1/Э-95). Найти выражение для разности теплоемкостей c р и c v
в виде, удобном для вычисления в случае произвольной системы через функции ее состояния. Проверить правильность найденного выражения
для ситуации идеального газа.
20. (1/1-01).
Докажите справедливость соотношения
c
p
−
c
ν
=T
(
∂P
∂T
)
V
(
∂V
∂T
)
P
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaam4yamaaBaaaleaacaWGWbaabeaakiabgkHiTiaadogadaWgaaWcbaGaeqyVd4gabeaakiabg2da9iaadsfadaqadaqaamaalaaabaGaeyOaIyRaamiuaaqaaiabgkGi2kaadsfaaaaacaGLOaGaayzkaaWaa0baaSqaaiaadAfaaeaaaaGcdaqadaqaamaalaaabaGaeyOaIyRaamOvaaqaaiabgkGi2kaadsfaaaaacaGLOaGaayzkaaWaa0baaSqaaiaadcfaaeaaaaaaaa@4BE2@
.
21. (4/1-99).
Докажите справедливость соотношения
c
p
−
c
ν
=−T
(
∂P
∂T
)
V
2
(
∂V
∂P
)
T
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaam4yamaaBaaaleaacaWGWbaabeaakiabgkHiTiaadogadaWgaaWcbaGaeqyVd4gabeaakiabg2da9iabgkHiTiaadsfadaqadaqaamaalaaabaGaeyOaIyRaamiuaaqaaiabgkGi2kaadsfaaaaacaGLOaGaayzkaaWaa0baaSqaaiaadAfaaeaacaaIYaaaaOWaaeWaaeaadaWcaaqaaiabgkGi2kaadAfaaeaacqGHciITcaWGqbaaaaGaayjkaiaawMcaamaaDaaaleaacaWGubaabaaaaaaa@4D8B@
22. (3/1-00).
Докажите справедливость соотношения
(
∂
c
P
∂V
)
T
2
=−T
(
∂
2
V
∂
T
2
)
P
(
∂P
∂V
)
T
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaWaaeWaaeaadaWcaaqaaiabgkGi2kaadogadaWgaaWcbaGaamiuaaqabaaakeaacqGHciITcaWGwbaaaaGaayjkaiaawMcaamaaDaaaleaacaWGubaabaGaaGOmaaaakiabg2da9iabgkHiTiaadsfadaqadaqaamaalaaabaGaeyOaIy7aaWbaaSqabeaacaaIYaaaaOGaamOvaaqaaiabgkGi2kaadsfadaahaaWcbeqaaiaaikdaaaaaaaGccaGLOaGaayzkaaWaa0baaSqaaiaadcfaaeaaaaGcdaqadaqaamaalaaabaGaeyOaIyRaamiuaaqaaiabgkGi2kaadAfaaaaacaGLOaGaayzkaaWaa0baaSqaaiaadsfaaeaaaaaaaa@51DE@
.
23. (1/1-03).
Показать, что
c
p
−
c
V
=−T[
(
∂
2
G
∂
T
2
)
p
−
(
∂
2
A
∂
T
2
)
V
]
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaam4yamaaBaaaleaacaWGWbaabeaakiabgkHiTiaadogadaWgaaWcbaGaamOvaaqabaGccqGH9aqpcqGHsislcaWGubWaamWaaeaadaqadaqaamaalaaabaGaeyOaIy7aaWbaaSqabeaacaaIYaaaaOGaam4raaqaaiabgkGi2kaadsfadaahaaWcbeqaaiaaikdaaaaaaaGccaGLOaGaayzkaaWaaSbaaSqaaiaadchaaeqaaOGaeyOeI0YaaeWaaeaadaWcaaqaaiabgkGi2oaaCaaaleqabaGaaGOmaaaakiaadgeaaeaacqGHciITcaWGubWaaWbaaSqabeaacaaIYaaaaaaaaOGaayjkaiaawMcaamaaBaaaleaacaWGwbaabeaaaOGaay5waiaaw2faaaaa@52A7@
.
24. (2/1-04).* Показать, что
c
p
−
c
V
=−T
∂
2
G
∂T∂P
∂
2
A
∂T∂V
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaam4yamaaBaaaleaacaWGWbaabeaakiabgkHiTiaadogadaWgaaWcbaGaamOvaaqabaGccqGH9aqpcqGHsislcaWGubWaaSaaaeaacqGHciITdaahaaWcbeqaaiaaikdaaaGccaWGhbaabaGaeyOaIyRaamivaiabgkGi2kaadcfaaaWaaSaaaeaacqGHciITdaahaaWcbeqaaiaaikdaaaGccaWGbbaabaGaeyOaIyRaamivaiabgkGi2kaadAfaaaaaaa@4D10@
.
Решение
25. (1/1-94). Для неидеального газа, подчиняющегося уравнению состояния
p
V
¯
=RT+BP+APT,
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaamiCamaanaaabaGaamOvaaaacqGH9aqpcaWGsbGaamivaiabgUcaRiaadkeacaWGqbGaey4kaSIaamyqaiaadcfacaWGubGaaiilaaaa@4108@
где
V
¯
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaWaa0aaaeaacaWGwbaaaaaa@36D9@
- мольный объем, А и В - характеристические постоянные газа. Найдите значение
c
p
−
c
ν
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaam4yamaaBaaaleaacaWGWbaabeaakiabgkHiTiaadogadaWgaaWcbaGaeqyVd4gabeaaaaa@3BB9@
.
26. (2/Э-02).
Мольный объем газа описывается уравнением состояния
V
¯
=
RT
P
+
βT
P
2
+γPT
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaWaa0aaaeaacaWGwbaaaiabg2da9maalaaabaGaamOuaiaadsfaaeaacaWGqbaaaiabgUcaRmaalaaabaGaeqOSdiMaamivaaqaaiaadcfadaahaaWcbeqaaiaaikdaaaaaaOGaey4kaSIaeq4SdCMaamiuaiaadsfaaaa@43DF@
где β = 1,424 м3Па2/K и
γ = 2,43 ·10 - 11 м3/(Па*K). Этот газ, находящийся изначально при
давлении 1 бар, нагревают от температуры 298 K до температуры 318 К и затем сжимают до давления 48 бар.
Определите изменение энтальпии для одного моля газа, если известно, что в
указанном температурном интервале изобарная мольная теплоемкость газа
практически постоянна и равна 31,56 Дж/моль К.
27. (1/1-06).* Обратимые процессы, в ходе которых теплоемкость системы C остаётся постоянной,
называют политропными. Найдите зависимость Р( V , T) для политропного процесса (уравнение политропы) для идеального газа. Какие
политропные процессы вам известны?
Решение
28. (1/1-00). Реальный газ описывается уравнением состояния
p
V
¯
=RT+aP+bPT
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaamiCamaanaaabaGaamOvaaaacqGH9aqpcaWGsbGaamivaiabgUcaRiaadggacaWGqbGaey4kaSIaamOyaiaadcfacaWGubaaaa@4098@
с константами α = 2,6 ·10 - 4 м3/моль
и β = 1,12· 10 - 6 м3/(моль· К).
Три моля этого газа изотермически (Т = 310 К) расширяются от
объема V1 = 30 л до объема V2 = 72 л. Рассчитайте изменение
молярной теплоемкости с P в этом процессе.
29. (3/1-04).
Для 1 моля газа, описанного в предыдущей задаче (1/1-00), рассчитать изменение энтальпии при сжатии от давления 1 атм, 273 К до давления
50 атм и температуры 318 К. Значение стандартной изобарной теплоемкости для этого газа сР0
составляет 28,8 Дж/(моль*К) и слабо зависит от температуры в указанном диапазоне температур.
30. (1/1-97). Реальный газ описывается уравнением состояния
P = RT/V + α /V2 с константой
α = 1,6 ·10 - 2 Па м6. Два моля этого газа
изотермически расширяются от объема V1 = 24 л до объема V2 = 48
л при температуре 300 К. Определите изменение молярной теплоемкости cV
в указанном процессе.
31. (1/1-07).
Для газа Дюпре, подчиняющегося уравнению состояния P( V - b) =RT, вычислите значения коэффициента Джоуля - Томпсона
μ JT=
(
∂T
∂P
)
H
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaWaaeWaaeaadaWcaaqaaiabgkGi2kaadsfaaeaacqGHciITcaWGqbaaaaGaayjkaiaawMcaamaaBaaaleaacaWGibaabeaaaaa@3CF9@
при давлении 3 ·104 Па и температуре 350 K. В указанной точке cP =
24 Дж/(моль.К). Величина b постоянна и равна 4,8·10 - 4 м3.
32. (1/Э-04).* Распространение звука в идеальном газе можно рассматривать как адиабатический процесс. Из гидродинамики
известно, что скорость звука с ={(∂P/∂ρ)адиаб}0,5,, где P – давление, а ρ плотность газа.
Найти скорость звука в гелии при комнатной температуре, если теплоемкость одноатомного идеального газа Сv = 3/2 R, атомный вес М
Не = 4.
Решение
33. (1/1-08). Студент-химик поет песню, вдохнув вместо воздуха гелий. Определите, как изменилась частота звука.
Известно, что скорость звука в газе определяется соотношением
υ=
V
α⋅M
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbqaq=labew8a1jabg2da9maakaaabaWaaSaaaeaacaWGwbaabaGaeqySdeMaeyyXICTaamytaaaaaSqabaaaaa@3FBE@
,
где
α=−
1
V
⋅
(
∂V
∂P
)
S
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaeqySdeMaeyypa0JaeyOeI0YaaSaaaeaacaaIXaaabaGaamOvaaaacqGHflY1daqadaqaamaalaaabaGaeyOaIyRaamOvaaqaaiabgkGi2kaadcfaaaaacaGLOaGaayzkaaWaaSbaaSqaaiaadofaaeqaaaaa@4488@
,
V – мольный объем газа, М – молярная масса газа. Изобарные теплоемкости воздуха и гелия равны 29,15 и 20,78 Дж/(моль
·К), соответственно. Газы считать идеальными.
34. (5/1-01). Найти температуру, при которой у жидкой воды теплоемкости при постоянном
давлении и постоянном объеме одинаковы,
если известно, что зависимость мольного объема воды от температуры дается
выражением:
V (см3) = 18,0011 – 0,00084 t + 0,00012
t2( 0 °C < t < 20 °C).
35. (5/1-94). В дьюаровский сосуд, содержащий 5 кг воды при температуре 303 К, внесли
1 кг снега при 263 К. Найдите изменение энтропии этой системы после установления термодинамического равновесия.
ΔHпл.снPснPв= 4,2 кДж/(кг
·×К).
36. (2/1-01). Энтальпия фазового перехода между двумя кристаллическими модификациями описывается выражением
ΔDфп H(T) = –12800 – 0.02 T2 (вДж/моль),
справедливым от 0 К до температуры фазового перехода. Найти температуру фазового перехода.
37. (2/1-98).* Вычислить изменение потенциала Гиббса в процессе затвердевания
1 кг переохлажденного бензола при 268,2 К. Давление насыщенного пара твердого бензола при
268,2 К 2279,8 Па, а над жидким бензолом при этой же температуре –
2639,7 Па. Вывести формулы для расчета. Пары бензола считать идеальным газом.
Решение
38. (2/1-03). При 298 К и давлении 0,1013 МПа
абсолютные энтропии ромбической серы и моноклинной серы равны 31,88 и 32,55 Дж (моль·К). Теплоты сгорания ромбической и
моноклинной серы соответственно равны –296,9 и –297,2 кДж/ моль. Найти значение ΔG0 для процесса превращения
серы ромбической в серу моноклинную при 298 К. Какая модификация серы при этих условиях более
устойчива?
39.(3/1-01). Рассчитать изменение энтропии при адиабатическом смешении 1 моля Не, в
зятого при
293 К и давлении 1 бар, с 2 молями О2, находящегося при 323 К и
давлении 1 бар. Давление результирующей смеси 1 бар. Известно, что СP Не
=5/2 R, С PО2 = 7/2 R.
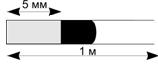 40.(6/1-03). В закрытой с одного конца металлической трубке диаметром d = 7,62 мм и
длиной
1 м в 5 мм от закрытого конца находится свинцовый грузик массой m = 9 г.
В пространстве между грузиком и замкнутым концом находится 0,1 моль газа под давлением 104
атм и с температурой 300 К. Газ начинает адиабатически расширяться, выталкивает грузик из трубки
и дальше
расширяется в атмосферу. Найти температуру выходящих из трубки газов и полную совершенную газом работу. Какая часть из этой работы приходится на выталкивание
грузика из трубки? Газ считать идеальным с с V = 16,62 Дж/
(моль ·К).
40.(6/1-03). В закрытой с одного конца металлической трубке диаметром d = 7,62 мм и
длиной
1 м в 5 мм от закрытого конца находится свинцовый грузик массой m = 9 г.
В пространстве между грузиком и замкнутым концом находится 0,1 моль газа под давлением 104
атм и с температурой 300 К. Газ начинает адиабатически расширяться, выталкивает грузик из трубки
и дальше
расширяется в атмосферу. Найти температуру выходящих из трубки газов и полную совершенную газом работу. Какая часть из этой работы приходится на выталкивание
грузика из трубки? Газ считать идеальным с с V = 16,62 Дж/
(моль ·К).
41. (4/1-96). Известно, что в термодинамических справочниках стандартные значения
термодинамических функций
Δ
f
H
298
o
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaeuiLdq0aaSbaaSqaaiaadAgaaeqaaOGaamisamaaDaaaleaacaaIYaGaaGyoaiaaiIdaaeaacaWGVbaaaaaa@3CA3@
и
S
298
o
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaam4uamaaDaaaleaacaaIYaGaaGyoaiaaiIdaaeaacaWGVbaaaaaa@3A27@
для газообразных веществ даны для стандартного давления газа 1 бар. В некоторых теоретических
расчетах вместо давления обычно используют концентрации газа, выраженные в числе частиц на 1 см3
объема; при этом за стандартные значения
Δ
f
H
298
o
′
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaeuiLdq0aaSbaaSqaaiaadAgaaeqaaOGaamisamaaDaaaleaacaaIYaGaaGyoaiaaiIdaaeaaceWGVbGbauaaaaaaaa@3CAF@
и
S
298
o
′
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaam4uamaaDaaaleaacaaIYaGaaGyoaiaaiIdaaeaaceWGVbGbauaaaaaaaa@3A33@
kfsin20.files/image002
принимают значения этих термодинамических функций при концентрации 1 частица в 1 см3.
Найти, как соотносятся величины
Δ
f
H
298
o
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaeuiLdq0aaSbaaSqaaiaadAgaaeqaaOGaamisamaaDaaaleaacaaIYaGaaGyoaiaaiIdaaeaacaWGVbaaaaaa@3CA3@
и
Δ
f
H
298
o
′
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaeuiLdq0aaSbaaSqaaiaadAgaaeqaaOGaamisamaaDaaaleaacaaIYaGaaGyoaiaaiIdaaeaaceWGVbGbauaaaaaaaa@3CAF@
,
а также
S
298
o
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaam4uamaaDaaaleaacaaIYaGaaGyoaiaaiIdaaeaacaWGVbaaaaaa@3A27@
и
S
298
o
′
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaam4uamaaDaaaleaacaaIYaGaaGyoaiaaiIdaaeaaceWGVbGbauaaaaaaaa@3A33@
для идеальных газов.
42. (5/1-95). Согласуются ли приведенные в таблице величины (в единицах
ккал/моль) друг с другом? Рассчитать из приведенных данных теплоту атомизации
твердых оксидов. Полагать
D
O
2
o
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaamiramaaDaaaleaacaWGpbWaaSbaaWqaaiaaikdaaeqaaaWcbaGaam4Baaaaaaa@399F@
= 118 ккал/моль.
| Оксид |
Δ
cубл
H
298
o
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaeuiLdq0aaSbaaSqaaiaadogacaWGdrGaamymeiaadUdbaeqaaOGaamisamaaDaaaleaacaaIYaGaaGyoaiaaiIdaaeaacaWGVbaaaaaa@3EEA@
|
I1 + I2
Me |
Δ
f
H
298
o
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaeuiLdq0aaSbaaSqaaiaadAgaaeqaaOGaamisamaaDaaaleaacaaIYaGaaGyoaiaaiIdaaeaacaWGVbaaaaaa@3CA3@
MeO |
E крист.решетки |
| MgO
CaO
BaO |
35,9
46,04
42 |
523
416
357 |
–143,7
–151,8
–133,0 |
944
844
750 |
43. (2/1-08). Найти абсолютную стандартную энтропию твердого аммиака при
Т = 15 К, если известно, что при этой температуре
c
p
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaam4yamaaBaaaleaacaWGWbaabeaaaaa@37F6@
= 0,84 Дж/(моль ·К), а в диапазоне температур 0 ÷25 К теплоемкость описывается формулой Дебая:
c
p
=a⋅
T
3
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaam4yamaaBaaaleaacaWGWbaabeaakiabg2da9iaadggacqGHflY1caWGubWaaWbaaSqabeaacaaIZaaaaaaa@3DF9@
.
44. (1/1-96). Определить теплоту образования
Δ
f
H
298
o
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaeuiLdq0aaSbaaSqaaiaadAgaaeqaaOGaamisamaaDaaaleaacaaIYaGaaGyoaiaaiIdaaeaacaWGVbaaaaaa@3CA3@
газообразных атомов фосфора, если известны теплоты следующих реакций:
|
Δ
r
H
298
o
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaeuiLdq0aaSbaaSqaaiaadAgaaeqaaOGaamisamaaDaaaleaacaaIYaGaaGyoaiaaiIdaaeaacaWGVbaaaaaa@3CA3@
, ккал/моль |
| 1. |
Ркрасн = Р4 (газ) |
13,2 |
2. |
Р4 (газ) = 2Р2 (газ) |
54,5 |
3. |
Р2 (газ) = 2Р (газ) |
116,8
|
45. (3/1-06).* Оценить величину энергии связи в молекуле О2, если известно,
что изобарный тепловой эффект каталитической реакции окисления орто-ксилола до фталевой кислоты,
записываемой уравнением
о-С8Н10(ж.) + 6О(г.)
= С8Н6О4(кр.) + 2Н2О(ж.),
равен
–2824,49 кДж/моль. Теплота сгорания фталевой кислоты равна 3223,33 кДж/моль.
| |
Δ
f
H
298
o
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaeuiLdq0aaSbaaSqaaiaadAgaaeqaaOGaamisamaaDaaaleaacaaIYaGaaGyoaiaaiIdaaeaacaWGVbaaaaaa@3CA3@
,
|
S
298
o
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaam4uamaaDaaaleaacaaIYaGaaGyoaiaaiIdaaeaacaWGVbaaaaaa@3A27@
,
|
C
p, 298
o
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaam4qamaaDaaaleaacaWGWbGaaiilaiaaykW7caaIYaGaaGyoaiaaiIdaaeaacaWGVbaaaaaa@3D47@
,
|
Δ
исп
H
MathType@MTEF@5@5@+=feaagaart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq=Jc9vqaqpepm0xbba9pwe9Q8fs0=yqaqpepae9pg0FirpepeKkFr0xfr=xfr=xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaeuiLdq0aaSbaaSqaaiaadIdbcaWGbrGaam4peaqabaGccaWGibaaaa@3AA9@
,
|
tкип,
|
| |
кДж/моль |
кДж/моль·K |
кДж/моль |
° С |
| CО2 (г)
Н2О (ж)
Н2О (г)
о-ксилол(ж.)
|
–393,51
–285,83
–241,82
–24,43
|
213,79
70,08
188,72
247
|
37,14
75,3
33,6
187,0
|
–
40,66
40,66
36,24
|
–
100
100
144
|
Решение  40.(6/1-03). В закрытой с одного конца металлической трубке диаметром d = 7,62 мм и
длиной
1 м в 5 мм от закрытого конца находится свинцовый грузик массой m = 9 г.
В пространстве между грузиком и замкнутым концом находится 0,1 моль газа под давлением 104
атм и с температурой 300 К. Газ начинает адиабатически расширяться, выталкивает грузик из трубки
и дальше
расширяется в атмосферу. Найти температуру выходящих из трубки газов и полную совершенную газом работу. Какая часть из этой работы приходится на выталкивание
грузика из трубки? Газ считать идеальным с с V = 16,62 Дж/
(моль ·К).
40.(6/1-03). В закрытой с одного конца металлической трубке диаметром d = 7,62 мм и
длиной
1 м в 5 мм от закрытого конца находится свинцовый грузик массой m = 9 г.
В пространстве между грузиком и замкнутым концом находится 0,1 моль газа под давлением 104
атм и с температурой 300 К. Газ начинает адиабатически расширяться, выталкивает грузик из трубки
и дальше
расширяется в атмосферу. Найти температуру выходящих из трубки газов и полную совершенную газом работу. Какая часть из этой работы приходится на выталкивание
грузика из трубки? Газ считать идеальным с с V = 16,62 Дж/
(моль ·К).