1. ФОРМАЛЬНАЯ КИНЕТИКА
1.3. Интегрирование
кинетических уравнений
Кинетические схемы с несколькими стадиями.
Параллельные и последовательные реакции
1.3.28. Получите выражения зависимостей концентраций A, B и C от времени и определите время достижения максимальной
концентрации промежуточного вещества В
для реакции, описывающейся кинетической схемой
А ![]() В
В ![]() С,
С,
если k1= 10–2 c–1,
k2 = 3 × 10–2 c–1. При t = 0 [A] = [A]0, [B] = [C] = 0.
Какое относительное количество вещества В следует добавить в исходное вещество А, чтобы время достижения максимальной
концентрации вещества [B]max
уменьшилось вдвое?
1.3.29. (КР1–2005, № 1). Метилфенилсульфид может
реагировать с Н2О2 по схеме
PhSMe + H2O2
![]() PhSOMe + H2O.
PhSOMe + H2O.
Образующийся сульфоксид может в
дальнейшем окисляться до сульфона:
PhSOMe + H2O2
![]() PhSO2Me + H2O.
PhSO2Me + H2O.
k1 = 1,5 × 10–3 М–1с–1,
k2 = 0,2 × 10–3 М–1с–1,
начальная концентрация сульфида равна C0,
перекись взята в большом избытке.
Определите концентрации сульфида, сульфоксида и сульфона
в момент, когда концентрация сульфоксида достигнет максимума.
1.3.30. (КР1–2001, № 4). Изотопный обмен дейтерия,
растворённого в воде, протекает при определённых условиях по механизму:
D2 +H2O ![]() HD
+ HDO
HD
+ HDO
HD
+ H2O ![]() H2 +HDO.
H2 +HDO.
Найдите зависимость концентрации HD от времени. [D2]0 = 10–3 M, [HD]0 = 10–4 M,
k1 = 2 k2.
1.3.31. (КР1–2003, № 1). Дейтерированный алкиламин
взаимодействует с большим избытком воды по схеме:
RND2 + H2O
![]() RNHD + HDO,
RNHD + HDO,
RNHD + H2O
![]() RNH2 + HDO.
RNH2 + HDO.
Найдите максимальную концентрацию RNHD, если k1
= 2 k2, а в начальный момент времени в системе был только дейтерированный
алкиламин с концентрацией X0.
1.3.32. Для
реакции, протекающей по механизму
X ![]() Y
Y ![]() Z,
Z,
найдите зависимость от времени концентраций веществ X, Y
и Z, если известны начальные
концентрации веществ CX(0)
= a, CY(0) = 0, CZ(0)
= 0.
1.3.33. (КР1–2008, № 5). Найдите кинетические
кривые для всех веществ, участвующих в последовательных мономолекулярных
превращениях
A ![]() B
B ![]() C
C ![]() D
D ![]() E
E ![]() G,
G,
если в начальный момент времени в системе присутствует только вещество А с концентрацией a.
1.3.34. Получите выражения зависимостей концентраций A, B, C и D от времени для реакции, описывающейся кинетической схемой

при начальных условиях t = 0, [A] = A0, [B] = [C] = [D] = 0.
1.3.35. Получите выражения зависимостей концентраций A, B, C и D от времени для реакции, описывающейся кинетической схемой
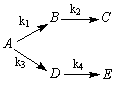
при начальных условиях t = 0, [A] = A0, [B] = [C] = [D] = [E] = 0.
1.3.36. Выведите кинетические уравнения для
расходования вещества A и накопления
веществ B и C, участвующих в реакции
B ![]() A
A ![]() C.
C.
Начальные концентрации веществ: CA(0) = С0,
CB(0) = CС(0) = 0.
1.3.37. Для
реакции, протекающей по механизму
A ![]() B
B![]() P,
P,
найдите
концентрации СА, CB и CР
веществ A, B и Р, как функции
времени, если начальные концентрации CA(0) = CB(0) = CP(0) = C0.
Изобразите
качественно графики функций CA(t), CB(t) и
CP(t) для случая k–1 >> k1
>> k2.
1.3.38. Найдите
точное решение прямой кинетической задачи для реакции, протекающей по механизму
А ![]() В
В
![]() С,
С,
в случае, когда ![]() = а,
= а, ![]() =
= ![]() = 0.
= 0.
1.3.39. Кинетика гидрирования нитрохлорбензола в
избытке водорода соответствует следующей схеме:
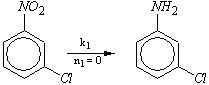
![]()
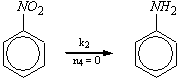
Здесь
ki (i = 1¸4) – эффективные константы скорости стадий реакции, ni
(i = 1¸4) – наблюдаемые порядки реакции по превращаемому
реагенту. Найдите время полного превращения исходного нитрохлорбензола и
концентрации всех продуктов в этот момент времени.
1.3.40. (Пе1–2007, № 2). Превращение реагента А протекает по трем параллельным
реакциям
1) A ![]() B,
B,
2) A ![]() C,
C,
3) A ![]() D.
D.
Эффективная константа скорости реакции k = k1 + k2 + k3 при температурах 460 и 520 °С
составила соответственно 17 и 56,5 с–1. При этом соотношение концентраций
продуктов [В] : [С] : [D] не зависело от температуры. Найдите энергии активации всех стадий.
1.3.41. В
системе протекают две параллельные реакции по уравнениям:
A + ![]() D,
D,
В + ![]() E.
E.
Отношение k1/k2 = 5. Сколько
процентов вещества В прореагирует к
моменту времени, когда вещество А
будет израсходовано на 95 %, если вещество С находится в избытке? Начальные концентрации А и В равны.
1.3.42. Для
схемы, приведенной в предыдущей задаче, рассчитайте процент превращения
вещества B к моменту времени, когда вещество А
будет израсходовано на 90 %, если k1/k2 = 10.
Вещество С находится в избытке.
1.3.43. Вещество А
по двум параллельным процессам первого порядка необратимо превращается в В и С:
1) А ¾® В,
2) А ¾® С.
Константа скорости реакции (2) в 100 раз меньше, чем
константа скорости реакции (1). Через 25 мин концентрация В составила 75 % от ![]() . Через какое время CB будет равна 75 % от
. Через какое время CB будет равна 75 % от ![]() ? (
? (![]() и
и ![]() – концентрации С и В при t ® ¥)?
– концентрации С и В при t ® ¥)?
1.3.44. (КР1–2007, № 4). Реакция
разложения изопропилового спирта протекает по схеме
![]() ,
,
![]() .
.
Реакция проводится в закрытом сосуде постоянного объёма. Отношение констант
скорости k1/k2 равно
0,8. Через 60 с после начала реакции концентрация ацетона составляет 50 % от её
конечного значения (т. е. значения после завершения реакции). Через какое
время после начала реакции концентрация пропилена будет составлять 75 % от её
конечного значения?
1.3.45. В
3,2 %-м (по весу) растворе метанола в воде образовались радикалы ![]() и
и ![]() в концентрации 10–5 моль/л
каждый. Радикалы гибнут по реакциям
в концентрации 10–5 моль/л
каждый. Радикалы гибнут по реакциям
![]() ,
,
![]() ,
,
причём
k1 = 109 М–1с–1, k2
= 104 М–1с–1.
В какой из реакций погибнет большая часть радикалов ![]() ? Оцените, во
сколько раз изменится концентрация радикалов
? Оцените, во
сколько раз изменится концентрация радикалов ![]() к моменту полной
гибели радикалов
к моменту полной
гибели радикалов ![]() . Плотность
раствора принять равной 1 г/cм3.
. Плотность
раствора принять равной 1 г/cм3.
1.3.46. (КР1–2006, № 1). Окисление стирола нестабильным оксокомплексом хрома (V) LCrVO протекает
одновременно с дезактивацией LCrVO. А и В – продукты превращения комплекса в
реакциях окисления субстрата и авто-распада:
C6H5CHCH2 + LCrVO
![]() C6H5CH(O)CH2 + А,
C6H5CH(O)CH2 + А,
LCrVO![]() B.
B.
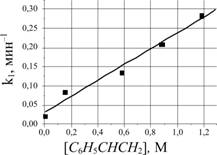
Эффективная
константа k1
скорости расходования комплекса зависит от концентрации стирола так, как
показано на рисунке. Оцените константы kA
и kB.
1.3.28. Газ А необратимо превращается одновременно по двум реакциям:
1) А ¾® В
(реакция первого порядка),
2) 2 А ¾® С (реакция
второго порядка).
В начальный момент в закрытом сосуде находился только
газ А, причём его концентрация была
такова, что скорости превращения по обоим путям были одинаковы. Найдите состав
системы после окончания реакций.
1.3.29. В смеси
веществ А, В, С при [А] >>([В] + [C]) протекают
параллельные реакции:
1) А
+ В
¾® D,
2) А
+ С
¾® Е.
Величина
k1 равна 0,5 М–1с–1. К моменту
полупревращения вещества В
концентрация вещества С уменьшилась в
5 раз. Определите величину k2.
1.3.30. В смеси
веществ А и В протекают параллельные реакции:
1) А + В ¾® C,
2) A ¾® D.
По
завершении реакции [C]¥ = 0,9 [B]0, [D]¥ = 0,023 M. Определите
величину отношения констант скорости реакций 1 и 2.
1.3.31. В
системе протекают конкурентные реакции
1) А
+ В ¾® D,
2) A
+ C ¾® Е,
Начальные
концентрации реагентов: [A]0 = 10–3 М;
[B]0 = 1,0 М;
[C]0 = 2 M.
Конечные концентрации продуктов: [E]µ = 1,67 × 10–4 М; [D]µ = 8,33 × 10–4 M. Константа
скорости k1 = 104 M–1 c–1.
Чему равна величина k2?
1.3.32. В
реакционной газофазной системе с постоянной скоростью 1010 см–3с–1
образуются активные частицы Х,
которые могут вступать в следующие превращения:
X ![]() A, k1 = 7 × 10–3 c–1,
A, k1 = 7 × 10–3 c–1,
X +
B ![]() C, k2 = 2 × 10–16 cм3 c–1.
C, k2 = 2 × 10–16 cм3 c–1.
Начальная скорость образования продукта С равна 2 × 109 см–3с–1,
температура равна 320 °С. Определите начальное давление в системе, считая,
что вещество В находится в большом
избытке.
1.3.33. Масс-спектроскопически при 130 °С изучали
скорости образования метана и этана при фотолизе газовых смесей азометана
(АМ) и
метиламина (RH). В зависимости от
состава смеси получено следующее:
|
[AM] × 103,
моль/л |
0,5 |
1,0 |
2,0 |
5,0 |
10,0 |
|
[RH] × 103,
моль/л |
0,05 |
0,3 |
1,0 |
4,0 |
10,0 |
|
WCH4× 109, моль/(л×с) |
1,0 |
1,5 |
5,0 |
8,0 |
12,0 |
|
WC2H6× 109, моль/(л×с) |
3,7 |
1,7 |
4,0 |
1,35 |
0,67 |
В этой системе метильные радикалы, образующиеся
при фотолизе азометана, взаимодействуют с азометаном и метиламином с
образованием метана (константы скорости k1 и k2), а также
рекомбинируют с константой скорости kp = 1,0 × 109 ![]() М–1c–1. По этим
экспериментальным результатам определите k1 и k2 (метод
конкурирующих реакций).
М–1c–1. По этим
экспериментальным результатам определите k1 и k2 (метод
конкурирующих реакций).
1.3.34. С
помощью импульсного фотолиза растворов дитретбутилперекиси измеряли начальные
скорости гибели радикалов ![]() в зависимости от их
начальной концентрации. Получены следующие результаты:
в зависимости от их
начальной концентрации. Получены следующие результаты:
|
[R·]0 × 105,
моль/л |
5 |
3 |
1 |
0,5 |
0,1 |
|
W0 × 103, моль/(л×с) |
600 |
240 |
40 |
15 |
2,2 |
Гибель радикалов в данной системе обусловлена
рекомбинацией (константа скорости k2) и мономолекулярным
превращением (константа скорости k1)
![]() .
.
Определите по этим результатам константы скорости k1
и k2.
1.3.35. (КР1–1998, № 5). Для
последовательно-параллельной реакции
![]() ,
,
![]() ,
,
известны значения констант k1 = k2 = 10–2 M–1c–1. Реакцию проводят с начальными концентрациями A0 = 1 M, B0 = 2 M, C0 = D0 = 0. Определите концентрации всех участников в момент
времени, когда концентрация интермедиата C достигает максимума.
1.3.36. (КР1–2001, № 5). Для
параллельно-последовательного процесса
A ![]() B
B ![]() C
C
A ![]() D
D
константы
скорости k1 = 1010 c–1, k2 = 103 c–1, k3 = 4 × 102 c–1 и константа равновесия стадии A ![]() B равна 1; [А]0 = 10–3 М.
B равна 1; [А]0 = 10–3 М.
Определите,
в каком соотношении находятся концентрации продуктов D и C после завершения
реакции. Найдите уравнение кинетической кривой для А.
1.3.37. (КР1–2002, № 2). Для следующей реакции найдите
отношение концентраций продуктов D и E после окончания реакции:
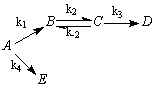
В начальный момент времени концентрация А равна А0, а концентрации всех остальных реагентов равны нулю.
1.3.38. При
облучении замороженного раствора щёлочи образуются электронные центры est,
которые могут либо гибнуть по мономолекулярному закону ![]() , либо реагировать с молекулами закиси азота, предварительно
растворённой в щёлочи:
, либо реагировать с молекулами закиси азота, предварительно
растворённой в щёлочи:
![]() .
.
Под
действием одного импульса электронного ускорителя образуется 2 × 1016 электронных центров/см3.
За 104 импульсов (каждый последующий импульс подавали после полного
исчезновения электронных центров) в образце объёмом 1 см3
образовалось
4,7 × 10–5 моль азота. Определите
отношение констант k1/k2, если начальная концентрация
закиси азота равна 10–
1.3.39. В водном
растворе H2SO4 при комнатной температуре
протекает окисление щавелевой кислоты комплексом Ru3+(bpy)3 по брутто-реакции
![]() .
.
Концентрации
[Ru3+(bpy)3]0 = 5 × 10–
Известно, что лимитирующей стадией
этой сложной реакции является одноэлектронное окисление комплексом молекул H2C2O4
или ![]() , причём константы скорости взаимодействия Ru3+(bpy)3 с этими формами
щавелевой кислоты k1 и k2 (обе в M–1×c–1) различные. По какому
временному закону будет происходить исчезновение Ru3+(bpy)3 в этих условиях?
Получите выражение для kэф. Каким образом можно определить в
эксперименте k1 и k2, если определена зависимость kэф
от [H+] при изменении [H2SO4] от 0,1 до
, причём константы скорости взаимодействия Ru3+(bpy)3 с этими формами
щавелевой кислоты k1 и k2 (обе в M–1×c–1) различные. По какому
временному закону будет происходить исчезновение Ru3+(bpy)3 в этих условиях?
Получите выражение для kэф. Каким образом можно определить в
эксперименте k1 и k2, если определена зависимость kэф
от [H+] при изменении [H2SO4] от 0,1 до
1.3.40. (КР1–2004,
№ 2). Вещество A может принимать участие в двух параллельных
процессах:
![]()
![]() .
.
Начальные концентрации равны [A]0 = [B]0 = a, [C]0
= [D]0 = 0. Найдите состав смеси после завершения реакций, если k1 = k2.
1.3.41. В
замкнутом реакторе проводят крекинг пропана, при котором промежуточным
соединением является этилен. Изменение концентрации этилена в общем случае
описывается выражением dCэт/dt =
wo – wp, где wo и wp - скорости образования и расходования этилена
соответственно. Для определения wo применили метод Неймана, заключающийся в
добавлении к системе малого количества радиоактивного этилена и регистрации
изменения концентрации этилена Сэт в системе и молярной
радиоактивности этилена b (доли радиоактивных молекул этилена). Было
обнаружено, что ![]() = -2 × 10–7 мин–1
при Сэт = 6 × 10–4 М. Найдите величину
wo.
= -2 × 10–7 мин–1
при Сэт = 6 × 10–4 М. Найдите величину
wo.
1.3.42. (Экз–2008, № 1). Гидролиз дифторида ксенона в
водном растворе происходит в результате последовательных реакций:
1) XeF2 + H2O ¾® 2 HF + XeO, k1 × [H2O] = 4 × 10–4 c–1;
2) XeO + H2O ¾® Xe + H2O2, k2 × [H2O] = 105×c–1;
3) H2O2+ XeF2 ¾® 2 HF + Xe + O2, k3
= 2 M–1×c–1.
Какая максимально возможная
концентрация перекиси может достигаться в ходе этой реакции? В начальный момент времени
перекись в системе отсутствовала.