1. ФОРМАЛЬНАЯ КИНЕТИКА
Константа
скорости реакции
1.4.30. Рассчитайте порядок реакции и
константу скорости распада диметилового эфира (CH3)2O ¾® CH4 + H2 + CO, основываясь на следующих кинетических данных:
|
t, с |
390 |
777 |
1195 |
3150 |
¥ |
|
DР × 10–4, Па |
1,28 |
2,35 |
3,33 |
6,23 |
8,25 |
1.4.31. Определите порядок реакции и константу
скорости на основании зависимости времени превращения на 25 % от
начального давления вещества.
|
Ро × 10–4,
Па |
1,06 |
1,19 |
1,43 |
1,64 |
|
t25%,
мин |
14 |
13 |
12 |
11 |
1.4.32. Исследовалась кинетика разложения диэтилперекиси
в газовой фазе при 160 °С. Парциальное давление перекиси менялось во
времени следующим образом:
|
t, c |
0 |
48 |
80 |
100 |
140 |
160 |
|
P, мм
рт. ст. |
300 |
271,5 |
242 |
228 |
206 |
196 |
Из этих
данных определите порядок реакции, оцените константу скорости реакции и энергию активации,
принимая предэкспонент k0 = 1016 c–1.
Каков вес перекиси, оставшейся в колбе объёмом
1.4.33. (Экз–2005, № 1). Определите по приведённым в
таблице данным порядок и константу скорости необратимой реакции изомеризации
цианата аммония в мочевину NH2CONH2 в водном растворе с начальной концентрацией [NH4CNO]0 =
|
t, мин |
0 |
20,0 |
50,0 |
65,0 |
150 |
|
С(мочевины), М |
0 |
0,117 |
0,202 |
0,23 |
0,295 |
1.4.34. Реакция в смеси двух газов А и В
при 230 °С протекает по закону порядка 3/2 для А и нулевого порядка для В.
Начальное давление газа A равно 15,7 мм рт. ст. Через час после начала
опыта в сосуде осталось 30 % газа A. Определите константу скорости этой реакции.
1.4.35. Определите порядок и константу скорости
реакции окисления NO кислородом, если начальная скорость реакции зависит
от состава смеси, как приведено ниже. Температура 50 °С.
|
W0 × 106,
М×c–1 |
1,2 |
4,8 |
2,4 |
|
PO2,
мм рт. ст. |
10 |
10 |
20 |
|
PNO,
мм рт.ст. |
10 |
20 |
10 |
1.4.36. Реакцию ![]() проводят при
273 К с начальной концентрацией каждого реагента 5 × 10–3 М.
Концентрация ОН–
уменьшается через 5 мин до 2,6 × 10–3 М, через 10 мин – до 1,7 × 10–3 М, через
15 мин – до 1,3 × 10–3 М.
проводят при
273 К с начальной концентрацией каждого реагента 5 × 10–3 М.
Концентрация ОН–
уменьшается через 5 мин до 2,6 × 10–3 М, через 10 мин – до 1,7 × 10–3 М, через
15 мин – до 1,3 × 10–3 М.
Покажите,
что реакция имеет второй порядок, и определите её константу скорости.
1.4.37. Определите характеристическое
время реакции
А + B ![]() P
P
при начальных концентрациях [А]0 = 10–3 М, [B]0 =
1.4.38. Оцените погрешность измерения константы
скорости необратимой мономолекулярной реакции А ¾® В
из следующих данных: реакция прошла на 50 % за время 2 ч, А0 = 10–3 моль/л,
В0 = 0. Погрешности
измерения времени и концентрации равны ±1 мин и
±10–5 моль/л соответственно.
1.4.39. Время жизни частицы А, вступающей в
реакции
А ![]() В
В ![]() С
С ![]() Р,
Р,
составляет
12 с. Найдите константу скорости k–1, если k1 = 1 c–1,
k2 = 20 c–1, k–2 = 100 c–1,
k3 = 30 c–1.
1.4.40. Для реакции
А1 ![]() А2
А2 ![]() А3
А3 ![]() Р
Р
константы скорости выражены в с–1. Найдите
эффективную константу скорости и время полупревращения частицы А1.
1.4.41. В начальный момент смесь содержит вещества А, В и С в равных концентрациях. Эти вещества независимо реагируют по
реакциям 1-го, 2-го и 3-го порядков с константами скорости
А ![]() Р1,
Р1,
В + В ![]() Р2,
Р2,
С + С
+ С ![]() Р3.
Р3.
Через какое-то время после начала реакций концентрации
А, В и С уменьшились в 5 раз? Рассчитать отношение величин начальных
скоростей этих реакций. Представить схематически в графической форме динамику
изменения [A], [B], [C] по ходу
протекания реакции.
1.4.42. С помощью метода импульсного фотолиза в
УФ-области исследовали кинетику реакции ![]() . Радикал
. Радикал ![]() образуется при
фотолизе паров воды. При давлении водорода 50 торр и температуре 300 К оптическая плотность D при l = 306,4 нм в
спектре поглощения радикала
образуется при
фотолизе паров воды. При давлении водорода 50 торр и температуре 300 К оптическая плотность D при l = 306,4 нм в
спектре поглощения радикала ![]() уменьшается с
увеличением времени t после действия импульса света следующим образом:
уменьшается с
увеличением времени t после действия импульса света следующим образом:
|
t × 106 c |
20 |
50 |
80 |
120 |
150 |
200 |
|
D (306,4 нм) |
1,3 |
0,78 |
0,25 |
0,13 |
0,05 |
0,01 |
Определите
по этим данным константу скорости этой реакции и оцените энергию активации,
если скорость уменьшения концентрации ![]() возрастает в 6 раз при
увеличении температуры на
возрастает в 6 раз при
увеличении температуры на
1.4.43. Вещество А
может образовывать димеры А2:
![]() A2.
A2.
При начальной концентрации [A]0 = 0,1 моль/л через 1 мин образовалось
0,015 моль/л димера, а через несколько часов – 0,036 моль/л. Найдите
константы скорости реакции образования димера и реакции его распада.
1.4.44. При изучении распада н-бромистого
пропила была получена следующая зависимость скорости распада от степени
превращения a при начальном давлении 1,24 × 104 Па и 436 °С:
|
a, % |
4,22 |
8,70 |
13,8 |
22,0 |
27,0 |
|
W, Па/мин |
40,4 |
33,9 |
28,9 |
21,7 |
17,5 |
Определите
порядок реакции и константу скорости.
1.4.45. Определите константу скорости и порядок
реакции, если известно, что при изменении начальной концентрации реагента от
1,0 до 0,2 М время полупревращения увеличилось с 2,0 до
50 мин. Определите начальную концентрацию реагента, если измерения его
концентрации, проведённые через 10 и 40 мин после начала реакции,
показали, что за время между этими измерениями изменение концентрации составило
0,1 М.
1.4.46. В растворе протекает реакция термического
распада азосоединения
R–N=N–R ¾® R2 + N2.
Через 1
мин после начала реакции выделилось 0,5 см3 азота, а при полном
протекании реакции – 1250 см3. Определите величину константы
скорости реакции 1-го порядка.
1.4.47. На рисунке приведена зависимость логарифма
скорости реакции (М–1с–1)
от логарифма концентрации исходного реагента (моль/литр) при двух температурах.
Определите порядок реакции, константу скорости реакции при 400 К и
энергию активации реакции.
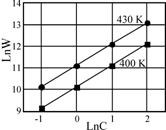
1.4.30. (Пе1–2004, № 3). Тримолекулярная реакция между
веществами А и В протекает в газовой фазе при 50 °С.
|
РА, атм |
500 |
125 |
250 |
250 |
|
РВ, атм |
10 |
15 |
10 |
20 |
|
t1/2, мин |
80 |
213 |
160 |
80 |
Определите
из приведенных данных порядки реакции
по компонентам и величину константы скорости в системе СГС.
1.4.31. Реакция гидролиза 4-бромбутанола (B) в водном растворе
H2O + Br(CH2)3CH2OH ¾® HBr + HO(CH2)3CH2OH
описывается
уравнением![]()
![]() М × с–1.
М × с–1.
Определите время полупревращения бромбутанола, если начальное
значение рН = 12 и [B]0 = 10–2 М.
1.4.32. Струя водорода со скоростью 14 м/с при
давлении 2 мм рт. ст. насыщалась парами тетраметилсвинца и
пропускалась через нагретую до высокой температуры печь, в которой это соединение, разлагаясь, давало радикалы CH3. Двигаясь дальше со струёй, радикалы CH3 удаляли (разрушали) сурьмяные зеркала, расположенные вдоль реактора на
различных расстояниях от печки.
Измерялось время t удаления (разрушения) зеркал в
зависимости от их расстояния L до печки.
|
L, см |
13 |
22 |
28 |
33 |
37 |
|
t, с |
20 |
45 |
70 |
100 |
150 |
Найдите
порядок и константу скорости реакции, приводящей к гибели радикалов, время
уменьшения концентрации радикалов вдвое.
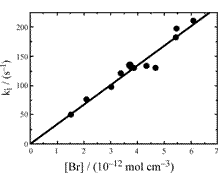
1.4.33. (Экз–2003, № 1). Реакция метокси-радикалов с большим избытком атомов брома в газовой фазе
при 298 К имеет псевдопервый порядок и характеризуется константой скорости
![]() . Рассчитайте с помощью изображённой на рисунке зависимости
. Рассчитайте с помощью изображённой на рисунке зависимости ![]() (c–1) от концентрации атомов
брома [Br] / (10–12
моль/см3) константу скорости k2 бимолекулярной реакции
(c–1) от концентрации атомов
брома [Br] / (10–12
моль/см3) константу скорости k2 бимолекулярной реакции
CH3O + Br ![]() CH2O + HBr .
CH2O + HBr .
1.4.34. (Пе1–2003, № 1). Реакция омыления метилацетата при 298 К
описывается уравнением
CH3COOCH3 + NaOH ¾® CH3COONa + CH3OH.
Для этой реакции получены следующие кинетические данные:
|
Время, мин |
3 |
5 |
7 |
10 |
15 |
25 |
|
CNaOH,
ммоль/л |
7,40 |
6,34 |
5,50 |
4,64 |
3,63 |
2,54 |
Исходные концентрации щёлочи и
эфира одинаковы и равны 10–3 моль/л. Определите порядок
реакции и константу скорости. Порядок реакции считать целочисленным.
1.4.35. В растворе с неизвестной концентрацией реагирующего вещества начальная скорость
была равна 2,5 × 10–4 М × с–1. Уменьшение скорости
реакции вдвое произошло за 800 с, а в четыре раза – за 1960 с.
Определите порядок реакции и величину константы скорости реакции.