1. ФОРМАЛЬНАЯ КИНЕТИКА
1.5. Приближённые методы решения кинетических уравнений. Метод квазистационарных концентраций. Квазиравновесное приближение
1.5.1.
Найдите
точное решение прямой кинетической задачи для реакции, протекающей по механизму
А ![]() В
В ![]() Х.
Х.
Покажите, как это решение переходит в приближённое
решение, соответствующее методу
стационарных концентраций. Начальные концентрации веществ: ![]()
![]() .
.
1.5.2.
При
каких ограничениях
на концентрации и константы скорости метод
стационарных концентраций применим для описания реакции
A + B ![]()
![]() D?
D?
1.5.3.
При
каких соотношениях
между константами можно использовать метод стационарных концентраций для
описания процесса
![]() B
B ![]()
1.5.4.
На
примере сложной реакции
А ![]() 2 В
2 В ![]() С
С
продемонстрируйте использование метода стационарных
концентраций. Укажите условия его
применимости.
1.5.5.
Определите
условие применимости метода стационарных концентраций для описания кинетики
сложной реакции
3 А ![]() 2 В
2 В ![]() 2 С.
2 С.
Начальные концентрации веществ CA0 = a, CB0 = CC0 = 0.
1.5.6.
Определите
условие применимости метода стационарных концентраций для описания кинетики
сложной реакции
А + 2 В ![]() 2 С,
2 С,
C + D ![]() P,
P,
если ![]()
![]() причём a >> b.
причём a >> b.
1.5.7.
При
каких соотношениях между константами можно использовать метод стационарных
концентраций для описания процесса
A ![]() 2 B
2 B ![]() C?
C?
1.5.8.
Выведите
условие применимости метода стационарных концентраций для описания кинетики
реакции, протекающей по механизму
![]() B
B ![]() X.
X.
Какой порядок имеет эта
реакция в стационарных условиях? Как её эффективная константа скорости связана
с константами скорости отдельных стадий? Какому режиму протекания реакции
соответствует случай k2 << k–1?
1.5.9.
Определите
условие
применимости метода стационарных концентраций для описания кинетики сложной
реакции
A + B ![]() C,
C,
C + D ![]() P,
P,
если ![]()
![]() причём a >> b.
причём a >> b.
1.5.1.
Превращение
изотопа 238U в изотоп 234U состоит из трёх последовательных
ядерных реакций:
![]()
Какова будет доля 234Th в смеси изотопов 238U, 234Th, 234Pa и 234U через 10, 20, 40 и 80 дней после начала распада чистого 238U? Через t1/2 обозначены времена полураспада изотопов.
1.5.2.
Реакция
выделения H2 из растворов
дважды восстановленных форм KH2 гетерополикислот идёт по механизму
KH2 ![]() K + H2,
K + H2,
K + KH2
![]() 2 KH,
2 KH,
где K – активное
промежуточное вещество.
Найдите выражения для
изменения концентраций веществ KH2 и H2
во времени. Чему равна константа скорости k1, если время полупревращения
вещества KH2
равно 20 мин?
Найдите
условие применимости метода стационарных концентраций для рассматриваемой
реакции. Каково время установления стационарной концентрации вещества K?
1.5.3.
Реакция
перекиси водорода с ионами Fe2+
происходит по схеме
![]()
![]()
![]()
![]()
Константы
скоростей стадий приведены в таблице:
|
k1 |
k2 |
k3 |
k4 |
|
10 M–1с–1 |
109 M–1с–1 |
10–10 см3/с |
10–12 cм3/с |
Найдите выражения для скоростей выделения О2 и расходования Fe2+ и Н2О2, полагая, что радикалы ![]() и
и ![]() очень
реакционноспособны. В каком диапазоне могут изменяться порядки реакций по
Fe2+ и Н2О2? Найдите стационарные концентрации частиц
очень
реакционноспособны. В каком диапазоне могут изменяться порядки реакций по
Fe2+ и Н2О2? Найдите стационарные концентрации частиц ![]() и
и ![]() и численные значения скоростей
стадий, если начальные концентрации реагентов равны [H2O2]0
= 0,1 М, [Fe2+]0
= 1015 см–3.
и численные значения скоростей
стадий, если начальные концентрации реагентов равны [H2O2]0
= 0,1 М, [Fe2+]0
= 1015 см–3.
1.5.4.
Термическое
разложение гидроперекиси ROOH
протекает по механизму
![]() , k1 =
10–4 c–1,
, k1 =
10–4 c–1,
![]() , k2 = 105 M–1c–1,
, k2 = 105 M–1c–1,
![]() , k3 = 104 M–1c–1,
, k3 = 104 M–1c–1,
![]() , k4 = 107 M–1c–1.
, k4 = 107 M–1c–1.
Определите квазистационарные концентрации
промежуточных частиц и скорость разложения гидроперекиси при CROOH = 0,1 M. Выведите
условия применимости метода квазистационарных концентраций в данном случае.
1.5.5.
Окисление
гидрохинона (QH2)
хлорноватистой кислотой в буферном растворе (рН > 7) протекает по
следующему механизму:
1) ![]()
![]()
![]() ,
,
2) ![]()
![]()
![]() .
.
Найдите зависимость концентрации ![]() от времени, если
известно, что характерное время установления равновесия (2) много меньше
характерного времени реакции (1), и равновесие (2) сильно сдвинуто влево в
сторону QH2 и Q. Гидрохинон взят в большом избытке [QH2]0 >> [HOCl]0.
от времени, если
известно, что характерное время установления равновесия (2) много меньше
характерного времени реакции (1), и равновесие (2) сильно сдвинуто влево в
сторону QH2 и Q. Гидрохинон взят в большом избытке [QH2]0 >> [HOCl]0.
1.5.6.
Механизм
окислительно-восстановительного взаимодействия V3+ и Cr2+ в водных растворах в общих чертах описывается следующей
схемой:
V3+ + Cr2+ + H2O ![]() [V(OH)Cr]4+ + H+,
[V(OH)Cr]4+ + H+,
[V(OH)Cr]4+
![]() V2+ + Cr(OH)2+,
V2+ + Cr(OH)2+,
Cr(OH)2+ + H+ ![]() Cr3+ + H2O (быстрое равновесие).
Cr3+ + H2O (быстрое равновесие).
Получите зависимость скорости восстановления ванадия и
скорости накопления Cr3+ от [H+], считая, что [V(OH)Cr]4+ –
высокореакционноспособная частица.
1.5.16. При холоднопламенном окислении бутана
углекислый газ может получаться как при окислении СО (со скоростью W1), так и за счёт распада ацильных
перекисных радикалов на СО2
и радикалы RO· (скорость
W2). Определите отношение скоростей этих процессов из результатов
следующего эксперимента (кинетический изотопный метод). Сразу после
установления стационарного режима реакции в реагирующую смесь добавили
некоторое количество СО, меченого
радиоактивными атомами 14С, так, что ее полная радиоактивность
составила 75 мКюри/моль. В дальнейшем отдельно измеряли радиоактивность СО2, образующегося в ходе
окисления. Её значение на начальном этапе реакции составило 3 мКюри/моль.
Какое
заключение о механизме реакции можно было бы сделать, если бы в этом
эксперименте радиоактивности СО и СО2 в тех же условиях
оказались равными?
1.5.17. Окисление органического соединения A комплексами Pd(II)
в водных растворах описывается схемой
1)
![]()
![]()
![]() ,
,
2)
![]()
![]()
![]() .
.
Получите выражение для кинетической кривой
накопления ![]() , если известно, что степень превращения A и Pd(II)
очень мала, а характерное время установления равновесия (2) много меньше
характерного времени установления равновесия (1).
, если известно, что степень превращения A и Pd(II)
очень мала, а характерное время установления равновесия (2) много меньше
характерного времени установления равновесия (1).
1.5.18. Реакция А
+ B ¾® D осуществляется в результате двух последовательных стадий:
1)
А ![]() Х,
Х,
2)
Х + B ![]() D.
D.
Получите выражение, описывающее зависимость
концентрации вещества D от времени,
если реакция (2) медленная, а стадия (1) практически равновесная; [A]0 = a, [B]0 = a,
[D]0 = 0.
1.5.19. Разложение N2O5 в газовой фазе описывается
схемой
1) N2O5
![]() NO2 + NO3,
NO2 + NO3,
2) NO3 ¾® NO + O2.
Получите выражение для скорости реакции как функции
концентрации N2O5 и NO2 в квазистационарном и квазиравновесном приближении.
Определите условия применимости этих приближений в каждом случае.
1.5.20. Разложение NO2Cl протекает по механизму
1) NO2Cl ¾® NO2 + Cl,
2) Cl + NO2Cl ¾® NO2 + Cl2.
Получите
выражение для скорости реакции в квазистационарном
приближении.
1.5.21. Синтез фосгена по реакции CO + Cl2 ¾® COCl2 протекает по механизму
Cl2 ![]() 2
2![]()
![]() + CO
+ CO ![]()
![]()
![]() + Cl2
+ Cl2 ![]() COCl2 +
COCl2 + ![]()
Выведите выражение для скорости реакции, если известно,
что ![]() и
и ![]() являются
высокореакционноспособными частицами. Каковы условия
применимости предлагаемых вами приближений?
являются
высокореакционноспособными частицами. Каковы условия
применимости предлагаемых вами приближений?
1.5.22. Реакция распада озона 2 O3 ¾® 3 O2
происходит по механизму
O3
+ M ![]() O2
+ O + M,
O2
+ O + M,
O + O3 ![]() 2 O2.
2 O2.
Пользуясь
методом стационарных концентраций, выведите уравнение для скорости реакции.
Чему равен порядок реакции по озону и веществу М в предельных случаях k2[O3] >> k–1[O2][M] и k2[O3]
<< k–1[O2][M]?
1.5.23. В результате исследования кинетических
закономерностей реакции окислительного хлорирования ацетилена в водных
растворах CuCl2 и CuCl установлено, что суммарный порядок реакции при
некоторых условиях равен 3.
Объясните
этот факт исходя из следующей кинетической схемы
1) A + CuCl ![]() X1
+ HCl,
X1
+ HCl,
2) X1 + 2 CuCl2
¾® X2 + CuCl,
3)
X2 ¾® P + 2 CuCl.
Здесь А – ацетилен, Р – продукт RCºCCl, а Х1,
Х2 – промежуточные
вещества.
1.5.24. (КР1–1997, № 5). Взаимодействие атомарного
кислорода с формальдегидом включает реакции:
1) ![]() , 2)
, 2) ![]() ,
,
3) ![]() , 4)
, 4) ![]() .
.
При
начальных условиях [CH2O] = 1016 см–3, [O] = 2 × 1013 см–3
было получено, что [CO2] = 4 × 1011 см–3, если отношение [O]/[O]0 = 0,68.
Принимая,
что ![]() и
и ![]() квазистационарны,
вычислите значение k2/k3 и найдите уравнение кинетической кривой для О.
квазистационарны,
вычислите значение k2/k3 и найдите уравнение кинетической кривой для О.
1.5.25. (КР1–1998, № 1). Для реакции, идущей по
механизму
![]() A
A ![]() B
B ![]() C
C![]() D,
D,
найдите
концентрацию вещества С в
зависимости от времени в квазиравновесном
приближении, если CA0 = a, CB0
= CC0 = CD0 = 0.
1.5.26. (КР1–2000, № 1). Для следующей кинетической
схемы найдите зависимости от времени концентрации веществ C и B в квазиравновесном
приближении:
A ![]() B
B ![]() C
C ![]() D.
D.
Начальные концентрации равны: CA0 = a, CB0 = CC0 = CD0 = 0.![]()
1.5.27. (КР1–2002, № 3). Найдите уравнение
кинетической кривой для промежуточного продукта B, появляющегося в реакции:
![]() (быстро, K – константа
равновесия),
(быстро, K – константа
равновесия),
![]() .
.
Равновесие устанавливается быстро. При t = 0 A = A0, B = P = 0.
1.5.28. (КР1–2000, № 2). Взаимодействие СО с озоном в атмосфере кислорода при T = 100 °C протекает по
механизму
O3 + M ![]() O + O2 + M,
O + O2 + M,
O3 + O ![]() 2 O2,
2 O2,
O + CO![]() CO2.
CO2.
Найдите зависимость скорости реакции от концентрации
реагентов в квазистационарном
приближении.
1.5.29.
(КР1–2000, № 5). Реакция ClO2 + Co(II) ® ClO2– + Co(III) в водных растворах протекает согласно следующему
механизму:
1) ClO2 + Co(II) ![]()
![]() , k1 = 1,6 M–1 c–1,
, k1 = 1,6 M–1 c–1,
2) CO(III) + Co(II)
![]() Coa, k2
= 0,5 M–1 c–1, k–2 = 0,1 c–1,
Coa, k2
= 0,5 M–1 c–1, k–2 = 0,1 c–1,
3) ClO2(III)
+ Coa ![]()
![]() , k3 = 1,1 × 103
M–1 c–1,
, k3 = 1,1 × 103
M–1 c–1,
где Coa – комплекс
неопределённой структуры, [Co(II)]0 = 2 × 10–4 M, [ClO2]0 = 2 × 10–4 M. Определите скорость реакции в момент времени, когда
[Co(II)] = 10–4 M. Справедливо ли применение метода стационарных
концентраций в данном случае?
1.5.30. (Экз–2003, № 4). Вещество X в водном растворе
представлено в двух таутомерных формах А
и В, которые находятся в равновесии
(К = 0,25).
Обе формы претерпевают мономолекулярные превращения по схеме
![]() (k1 = 0,1 мин–1,
k2 = 0,6 мин–1).
(k1 = 0,1 мин–1,
k2 = 0,6 мин–1).
В начальный момент времени был приготовлен водный
раствор X с концентрацией
1.5.31. (КР1–2004, № 1).
Гидролиз изоцианатов может протекать по одному из двух механизмов, в каждом из
которых лимитирующей стадией является образование карбаминовой кислоты. Концентрации
промежуточных комплексов X1 и X2 предполагаются квазистационарными.
Р – продукты, Ac – кислота. Получите выражения для скорости реакции для двух
предполагаемых механизмов.
|
Механизм
1
|
Механизм
2
|
1.5.32. (КР1–2003, № 2). Комплекс CoII устойчив в растворе чистого CHCl3. Однако если в системе присутствует метанол,
то CoII
окисляется по схеме
CoII + MeOH ![]() XII, k1 = 103 M–1c–1,
k–1 = 10 c–1,
XII, k1 = 103 M–1c–1,
k–1 = 10 c–1,
XII + O2 ![]() XIII, k2 = 10–2
M–1c–1,
XIII, k2 = 10–2
M–1c–1,
XIII ![]() P+ + O2–, k3
= 1 c–1,
P+ + O2–, k3
= 1 c–1,
где XII º [CoII(MeOH)],
XIII º [CoIIIO2(MeOH)],
P+ º [CoIII(MeOH)]+.
Не
знавший об этом студент приготовил 10–3 М раствор CoII в хлороформе, содержащем 0,11 М
метанола, и ушел на обед. Оцените, через какое время содержание кобальта (II) составит 50 % от исходного количества кобальта,
если раствор насыщен кислородом до концентрации 5 × 10–2 М, а равновесие в
первой реакции устанавливается быстро, XIII – высокореакционноспособная
частица.
1.5.33.
(Пе1–2003, № 4). Реакция конверсии пара-водорода в орто-водород протекает по следующему механизму (M – инертная
частица):
p-H2 + M ![]() H · + H · + M,
H · + H · + M,
H · + p-H2 ![]() H · + о-H2,
H · + о-H2,
H · + H · + M ![]() p-H2 +
M.
p-H2 +
M.
Используя
метод стационарных концентраций, получите выражение для скорости конверсии пара-водорода.
1.5.34. (КР1–2002, № 5). В системе присутствует
вещество А с концентрацией А0, которое может вступать в химические превращения по
схеме
A ![]() 3 B,
3 B,
2 B ![]() C,
C,
где B – очень реакционноспособная
частица.
Определите
условие
применимости метода квазистационарных концентраций. Найдите выражение для
скорости образования С в момент
времени, когда концентрация А равна
концентрации С.
1.5.35. (КР1–2001, № 2). Для последовательной схемы
превращения
![]() B
B ![]() C
C
известны значения констант скорости и энергии
активации:
|
k1A0 = 2,8 × 10–7
c–1 |
k–1 = 3,3 × 10–2 c–1 |
k2 = 4,4 × 10–3 c–1 |
|
E1 = 40,0 ккал/моль, |
E–1 = 33,0 ккал/моль, |
E2 = 35,0 ккал/моль |
Найдите энергию активации
суммарного процесса
1.5.36.
(Экз–2007, № 1). В закрытой системе проходят
следующие реакции:
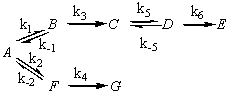
Найдите концентрации всех веществ
после окончания реакций, если в начальный момент времени присутствует только
вещество А c
начальной концентрацией [A]0
= a. Константы скорости отдельных стадий, выраженные в c–1 равны: k1 = 100; k–1 = 200; k2 = 300; k–2 = 150; k3 = 12; k4 = 8; k5 = 250;
k–5 = 190; k6 = 320.
1.5.37.
(КР1–2006, № 2). Разложение азотной кислоты в
газовой фазе протекает по сложному механизму с образованием
высоко-реакционноспособных промежуточных частиц ОН, NO и NO3:
HNO3 ¾® OH + NO2 k1
OH + NO2 ¾® HNO3 k2
OH + HNO3 ¾® H2O + NO3 k3
NO3 + NO2 ¾® NO2 + O2 + NO k4
NO3 + NO ¾® 2 NO2 k5
Экспериментальная зависимость скорости образования кислорода при низких концентрациях NO2
выражается формулой
W = a·
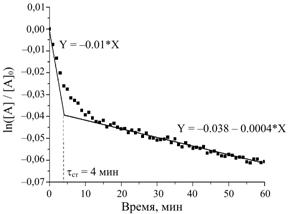
1.5.38. (КР1–2005, № 5). Для реакции, протекающей по
схеме
A![]() B
B ![]() C,
C,
оцените
константы скорости элементарных стадий k1, k–1 и k2, используя представленную на следующем
рисунке экспериментальную кинетическую кривую.
1.5.39.
(КР1–2007, № 1). Окисление органического сульфида R1SR2 до сульфоксида
может катализироваться комплексами титана Ti и TiL, где L – хиральный
лиганд, причём TiL катализирует образование (R)-изомера сульфоксида, а Ti – образование
рацемического сульфоксида:
Ti + L ![]() TiL (быстрое равновесие)
TiL (быстрое равновесие)
TiL + R1SR2 + H2O2 ![]() TiL + H2O + сульфоксид-(R)
TiL + H2O + сульфоксид-(R)
Ti + R1SR2 + H2O2 ![]() Ti + H2O + сульфоксид-(рацемич. смесь).
Ti + H2O + сульфоксид-(рацемич. смесь).
В колбу поместили Ti и лиганд в равных концентрациях Ti0 = L0, добавили пероксид водорода и сульфид. Начальные концентрации
комплекса и лиганда выбрали так, что K = 1/Ti0 = 1/L0. Найдите оптическую чистоту (СR – CS) / (CR + CS) образующегося сульфоксида, если k1/k2 = 10.
1.5.40.
(КР1–2007,
№ 3). Разложение гидроперекиси кумола ROOH в присутствии ионов
железа(II) происходит в
соответствии со схемой
FeII + ROOH![]() FeIII +
FeIII + ![]() ,
,
![]()
![]()
![]() ,
,
![]()
![]() C2H6.
C2H6.
Начальная квазистационарная
скорость выделения газообразного этана из раствора объёмом 100 см3 составила
4,8 см3/с при 298 К и давлении 1 атм. Начальные концентрации ионов
железа(II) 10–
1.5.41. (КР1–2008, № 1).
Комплекс железа (V) FeV способен окислять алкен A в ацетонитриле в соответствии со схемой
FeV + A ![]() FeIII + продукт
FeIII + продукт
FeV + FeIII ![]() FeIVFeIV.
FeIVFeIV.
Обнаружено,
что зависимость концентрации FeV от
времени соответствует приведённому графику,
если начальные концентрации FeV и A равны 0,05 М. Найдите
значение k1, если известно, что FeIII – очень реакционноспособная частица, а димер FeIVFeIV – инертное соединение.
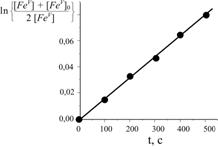
1.5.42.
(КР1–2008, № 4). Гидролиз изоцианатов может
протекать с промежуточным образованием карбаминовой кислоты по следующему
механизму:
1) H2O + R3N ![]() X,
X,
2) X + RNCO ![]() RNH–COOH + R3N,
RNH–COOH + R3N,
3) RNH–COOH + H2O![]() RNH2 + H2CO3 (быстро).
RNH2 + H2CO3 (быстро).
Концентрации X и карбаминовой кислоты предполагаются квазистационарными.
Получите выражение для начальной скорости реакции в квазистационарном
приближении. Найдите эффективную энергию активации реакции при малых степенях
превращения, полагая известными энергии активации всех стадий.
1.5.43.
(КР1–1997,
№ 4). Образование АВ2
происходит в результате реакций
1) A + B ![]() AB, 2) AB + B ¾® AB2.
AB, 2) AB + B ¾® AB2.
Оцените значение скорости реакции в момент, когда [A] уменьшится на 1/3,
если k1 = 103 M–1c–1, k–1 = 104 c–1, k2 = 106 M–1c–1, а начальные концентрации равны: [A]0 = [B]0 = 3 × 10–3 М.