2. АБСОЛЮТНЫЕ ЗНАЧЕНИЯ
СКОРОСТЕЙ ХИМИЧЕСКИХ РЕАКЦИЙ
2.3. Изотопные эффекты
2.3.1.
Реакция
нитрирования ароматических углеводородов описывается
схемой
ArONO2 ![]() ArO– + NO2+,
ArO– + NO2+,
NO2+ + ArH ![]() ArNO2 + H+.
ArNO2 + H+.
В параллельных опытах было
показано, что скорости нитрирования бензола и гексадейтеробензола при равных
начальных концентрациях реагентов одинаковы и описываются уравнением
W
= kН ×[ArONO2].
Однако
в опыте с одновременным присутствием равных количеств бензола и
гексадейтеробензола скорости их расходования различны. Скорость расходования
бензола в четыре раза выше, чем скорость расходования гексадейтеробензола.
Объясните эти результаты.
2.3.2.
Используя
теорию активированного комплекса, выведите формулу, описывающую кинетический изотопный эффект для
реакции между органической молекулой R–H
и радикалом ![]() :
:
![]() ,
,
![]() ,
,
при
условии, что массы свободных радикалов ![]() и
и ![]() и
атома
и
атома ![]() удовлетворяют условиям
удовлетворяют условиям
![]() ,
, ![]() .
.
Оцените
кинетический изотопный эффект при 300 К, считая, что частота валентного
колебания связи R–H равняется
3000 см–1, а вкладом других колебаний можно пренебречь.
2.3.3.
Оцените
вклады поступательных, вращательных и колебательных степеней свободы в кинетический изотопный эффект для
реакции
![]() + C3 H8 ¾® H2 +
+ C3 H8 ¾® H2 + ![]() H7,
H7,
![]() + C3 H8 ¾®
HD +
+ C3 H8 ¾®
HD + ![]() H7
H7
и величину суммарного изотопного эффекта при
температуре 300 К. При расчёте необходимо учесть дважды вырожденные
деформационные колебания атакующего атома в переходных комплексах с частотами ![]() = 400 см–1 и
= 400 см–1 и ![]() = 350 см–1.
= 350 см–1.
2.3.4.
Оцените
вклады поступательных, вращательных и колебательных степеней свободы в
кинетический изотопный эффект для реакции
![]() ,
,
![]()
и величину суммарного изотопного эффекта при
температуре 300 К. При расчёте необходимо учесть дважды вырожденные
деформационные колебания атакующего атома в переходных комплексах с частотами ![]() = 400 см–1 и
= 400 см–1 и ![]() = 350 см–1.
= 350 см–1.
Оцените вклады поступательных, вращательных и
колебательных степеней свободы в кинетический изотопный эффект для реакции
![]() ,
,
![]()
и величину суммарного изотопного эффекта при
температуре 300 К. При расчёте необходимо учесть дважды вырожденные
деформационные колебания атакующего атома в переходных комплексах с частотами ![]() = 400 см–1 и
= 400 см–1 и ![]() = 350 см–1.
= 350 см–1.
2.3.4п.
Методом активированного комплекса рассчитайте отношение предэкспоненциальных
множителей реакции
Cl + H2 ¾® HСl + H,
Cl + D2 ¾® DСl + D,
считая активированный комплекс линейным с длинами
связей ![]() Å,
Å, ![]() Å. Расчёт проведите при
температурах, когда колебательные статистические суммы исходных молекул и
активированных комплексов можно считать равными единице.
Å. Расчёт проведите при
температурах, когда колебательные статистические суммы исходных молекул и
активированных комплексов можно считать равными единице.
2.3.5.
Пользуясь
теорией активированного комплекса, оцените стерический
фактор реакции
D + I2 ¾® DI + I ,
протекающей через линейный активированный комплекс, и
величину изотопного эффекта при замене D
на H. Температура 300 К. Частота
дважды вырожденных деформационных колебаний в комплексе составляет ![]() = 400 см–1,
= 400 см–1,
![]() = 280 см–1.
= 280 см–1.
2.3.6.
Вычислите
вклад поступательных степеней свободы в кинетический изотопный эффект для реакций отрыва атома ![]() от молекулы
углеводорода RH атомами
от молекулы
углеводорода RH атомами ![]() и
и ![]() .
.
2.3.7.
Рассчитайте
изотопный эффект в реакциях
СH4 + ![]() ¾®
¾® ![]() + HCl,
+ HCl,
СD4 + ![]() ¾®
¾® ![]() + DCl
+ DCl
при
500 К для линейного активированного комплекса
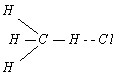
при длине связи С–Н,
равной 1,1 Å; H–Cl, равной
1,3 Å. В колебательной статистической сумме учесть только 4
колебания активированного комплекса, приняв ![]()
![]() . Для молекулы метана nCH = 3000 см–1.
. Для молекулы метана nCH = 3000 см–1.
2.3.8.
(КР2–2004,
№ 4). Оцените отношение констант скорости при 200 К для реакции
![]() ,
,
![]() ,
,
учитывая,
что частота валентного колебания С–Н
в молекуле метана равна 3000 см–1. При решении пренебречь вкладом
изотопного эффекта в поступательные степени свободы и изменением момента
инерции переходного комплекса.
Реакция протекает через трехцентровый активированный
комплекс, причём атомы C–H–Cl лежат на одной
прямой, а положения атомов водорода в метильной группе эквивалентны:
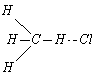 .
.
2.3.9.
(КР2–2003,
№ 2). Оцените кинетический изотопный
эффект для распада хлороформа и тритохлороформа (отщепление изотопа
водорода) при 500 К. Волновое число валентного колебания С–Н
в хлороформе 3032 см–1, вкладом деформационных колебаний пренебречь.
2.3.10. (КР2–2000, № 4). Оцените величину
кинетического изотопного эффекта для реакции
CH2DCOOH
+ CH3COO ¾® CH2COOH + CH3COOD,
kD
CH2DCOOH
+ CH3COO ¾® CHDCOOH + CH3COOH, kH
при температуре 298 К, если частота валентного
колебания C–H составляет 3000 см–1 (деформационные колебания не
учитывать).
2.3.11. (КР2–2002, № 2). Оцените отношение констант
скоростей для реакции
![]() ,
,
![]() .
.
Атомы D и H находятся в пара-положении,
wС–H = 3050 см–1,
Т = 300 К. Деформационные колебания не учитывать.
2.3.12. Оцените вклад поступательных, вращательных и
колебательных степеней свободы в кинетический изотопный эффект для реакции
H2 + R ¾® H + HR,
HD + R ¾® D + HR.
Считать,
что ![]() >>
>>![]() , wH–H = 4396,5 см–1. В переходном
комплексе имеются дважды вырожденные деформационные колебания
, wH–H = 4396,5 см–1. В переходном
комплексе имеются дважды вырожденные деформационные колебания ![]() = 400 см–1,
= 400 см–1,
![]() = 280 см–1. Т = 300 К.
= 280 см–1. Т = 300 К.
2.3.13. (КР2–2007, № 5). Оцените кинетический изотопный эффект при
500 К в реакциях
1) SiH4 + I ¾® SiH3 + HI,
2) SiD4 + I ¾® SiD3 + DI.
Молекула силана имеет тетраэдрическое строение, частота валентного
колебания в силане nSiH = 2190 см–1.
Изменение частот других колебаний в активированном комплексе не учитывать. Активированные
комплексы имеют ось симметрии третьего порядка Si×××(H)×××I, MSi = 28 г/моль.
2.3.14. (КР2–2008, № 4).
Рассчитайте кинетический изотопный эффект при 300 К для реакции
H + H2 ![]() [ H···H···H ]≠ ¾® H2 + H
[ H···H···H ]≠ ¾® H2 + H
D + H2 ![]() [ D···H···H ]≠ ¾® HD + H,
[ D···H···H ]≠ ¾® HD + H,
если известно, что в активированном комплексе частота деформационных
колебаний в обоих случаях близка, а волновые числа симметричных валентных
колебаний nH и nD равны 2012 и 1732 см–1 соответственно. Активированный комплекс
имеет линейное строение с одинаковыми расстояниями RH–H и RD–H.
2.3.15. (Экз–2006, № 4).
Оцените кинетический изотопный эффект для реакции образования нитрометильного
катиона в водном растворе при температуре 298 К, ![]() :
:
CH3NO2 + OH–
¾® ![]()
CD3NO2 + OH–
¾® ![]() .
.