3. КИНЕТИКА СЛОЖНЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ
3.1. Цепные неразветвлённые процессы
3.1.1. Найдите среднюю концентрацию радикалов в газе
в цилиндрическом сосуде радиуса r, если скорость их образования в объёме равна
W0, а гибель идёт только на стенке с эффективностью e. Известны средняя скорость движения радикалов
u и их коэффициент диффузии D.
Определите константу скорости гибели радикалов,
считая, что в сосуде протекает цепная реакция в стационарном режиме, т. е. скорость образования радикалов равна скорости их
гибели Wг.
3.1.2. Цепная реакция хлора с
водородом протекает по схеме:
![]()
![]()
![]()
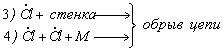
Скорость инициирования равна 1012 см–3×с–1. Давление каждого из реагентов
10 мм рт. ст., температура 300 К, реактор цилиндрический
диаметром ![]() и
и ![]() в стационарном режиме,
начальную скорость образования HCl,
длину цепи.
в стационарном режиме,
начальную скорость образования HCl,
длину цепи.
3.1.3. Выведите выражения для длины цепи реакции
хлорирования Н2
молекулярным хлором при фотохимическом инициировании этой реакции и двух
различных типах реакции обрыва: чисто линейном и чисто квадратичном.
3.1.4. Неразветвлённая цепная реакция
Н2 + Cl2 ¾®
2 HCl
в стехиометрической смеси Н2 и Cl2
протекает в условиях, когда стадией зарождения цепи является термический распад
молекул Cl2, а стадией
обрыва цепи – рекомбинация атомов ![]() в объёме. При этом концентрация атомов
в объёме. При этом концентрация атомов ![]() является равновесной.
является равновесной.
Какое из сформулированных ниже утверждений
относительно концентрации атомов в системе является верным в этих условиях:
1) концентрация атомов ![]() меньше равновесной;
меньше равновесной;
2) концентрация атомов ![]() равна равновесной;
равна равновесной;
3) концентрация атомов ![]() больше равновесной?
больше равновесной?
При оценках принять Т = 800 K.
Под равновесными концентрациями ![]() и
и ![]() понимаются их
равновесные концентрации в чистом Cl2
и чистом Н2, взятых при
той же температуре и давлении, что и в условиях цепной реакции.
понимаются их
равновесные концентрации в чистом Cl2
и чистом Н2, взятых при
той же температуре и давлении, что и в условиях цепной реакции.
Энергии разрыва связей равны: Е(Cl–Cl) = 57 ккал/моль, E(H–H) = 103 ккал/моль, Е(H–Cl) = 102 ккал/моль.
3.1.5. Как меняется длина цепи неразветвлённой цепной
реакции с квадратичным обрывом цепей:
а) при повышении температуры (термическое
инициирование);
б) с ростом концентрации реагентов;
в) с ростом интенсивности облучения (фотохимическое
инициирование);
г) при добавлении радикальных ловушек?
3.1.6. В замкнутом сосуде протекает неразветвлённая
цепная реакция с квадратичным обрывом цепи. Как будет меняться длина цепи:
а) с понижением температуры;
б) при добавлении в реакционную смесь инертного газа*;
в) при увеличении концентрации исходных реагентов?
Как будет меняться при разбавлении смеси инертным
газом длина цепи фотохимически инициируемой реакции хлорирования водорода при:
1) квадратичном и
2) линейном (диффузионная область) обрыве цепей?
3.1.7. Как будет меняться при разбавлении смеси инертным
газом длина цепи реакции
хлорирования водорода в случае термического или фотохимического инициирования
при: 1) квадратичном и 2) линейном (диффузионная область) обрыве цепи?
3.1.8. При добавлении хлора в систему Н2–Cl2 длина
цепи уменьшится, увеличится или останется неизменной при: 1) линейном обрыве в
кинетической области; 2) линейном обрыве в диффузионной области; 3)
квадратичном обрыве? Рассмотреть случаи термического и фотохимического инициирования.
3.1.9. При добавлении инертного газа в систему Н2–Cl2 длина
цепи уменьшится, увеличится или останется неизменной при:
1) линейном обрыве в кинетической области;
2) линейном обрыве в диффузионной области;
3) квадратичном обрыве?
3.1.10. Оценить длину цепи реакции Н2 + Cl2 = 2 HСl
в присутствии 0,001 % NCl3,
если атомы хлора гибнут по реакции
![]()
протекающей без энергии активации, а константа
скорости реакции
![]()
равна 10–10 exp(E/RT) см3/с,
E = 24,1 кДж/моль. Начальное давление
стехиометрической смеси хлора и водорода 2,67 × 104 Па, Т = 220 °С.
3.1.11. (Экз–2008, № 4). При изучении термического
распада бромистого н-пропила была получена следующая зависимость
эффективной константы скорости реакции от температуры:
|
Температура, °С |
300 |
380 |
|
k × 103, см3/2
моль–1/2 с–1 |
9,54 |
346 |
Определите длину цепи при 350 °С при давлении бромистого н-пропила 5,33 ž 104 Па. Инициирование цепи протекает
по реакции
![]() .
.
Энергия разрыва связи С–Вr в бромистом пропиле 284,2 кДж/моль.
3.1.1. Найдите длину цепи неразветвлённой цепной
реакции, если в отсутствие ингибитора её скорость равна 8 × 10–3 М/мин. Ингибитор, прибавленный в
количестве 4,8 × 10–2 М, полностью расходуется за 4 ч.
3.1.2. Цепная неразветвлённая реакция с участием
углеводородных радикалов ![]() протекает со скоростью
1,8 торр×с–1. При введении в систему NO (1 торр) процесс прекращается, а
через 5 мин возобновляется с прежней скоростью. В продуктах реакции
обнаруживаются малые количества нитрозосоединений RNO. Определите длину цепи в отсутствие ингибирующей добавки NO.
протекает со скоростью
1,8 торр×с–1. При введении в систему NO (1 торр) процесс прекращается, а
через 5 мин возобновляется с прежней скоростью. В продуктах реакции
обнаруживаются малые количества нитрозосоединений RNO. Определите длину цепи в отсутствие ингибирующей добавки NO.
3.1.3. (КР3–2004, № 2). Разложение перекиси водорода
при фотохимическом инициировании протекает по механизму цепной неразветвлённой
реакции:
0) Н2О2 = 2 ОН· W0 = 10–7
М×с–1,
1) ОН· + Н2О2
= НО2· + Н2О k1 = 3 × 107
М–1×с–1,
2) НО2· + Н2О2 = Н2О + О2 + ОН· k2 = 30 М–1×с–1,
3) НО2· + НО2· = Н2О2 + О2 k3 = 2 × 105
М–1×с–1.
Найдите скорость разложения перекиси при её
концентрации
3.1.4. Реакция образования ROOH идёт по механизму:
0)![]() ,
,
1)![]() ,
,
2)![]()
3)![]() .
.
Получите выражение для скорости образования ROOH в отсутствие ингибитора. В
присутствии ингибитора In добавляется
стадия
4) ![]()
Нарисуйте графики зависимости скорости поглощения
кислорода и скорости образования гидроперекиси от концентрации ингибитора.
3.1.5. Термическое разложение ацетальдегида протекает
по следующему механизму:
0) ![]() , DH = +81 ккал/моль,
, DH = +81 ккал/моль,
1)
![]() , DH = –16,4 ккал/моль,
, DH = –16,4 ккал/моль,
2)
![]() , DH = +11,9 ккал/моль,
, DH = +11,9 ккал/моль,
3) ![]() , DH = –88 ккал/моль.
, DH = –88 ккал/моль.
Определите эффективный порядок и эффективную энергию активации
реакции. При каких температурах и давлениях необходимо учитывать обрыв цепей за
счёт рекомбинации радикалов ![]() ?
?
3.1.6. (Пе1–2006, № 4). Найдите выражение для
скорости пиролиза ацетальдегида и стационарные концентрации радикалов, считая цепи длинными.
0) CH3CHO ¾® ![]() +
+ ![]() ,
,
1) ![]() + M ¾®
+ M ¾® ![]() + CO +M,
+ CO +M,
2) ![]() + CH3CHO ¾®
+ CH3CHO ¾® ![]() + H2,
+ H2,
3) ![]() + CH3CHO ¾® CH4 +
+ CH3CHO ¾® CH4 + ![]() ,
,
4) ![]() + M ¾®
+ M ¾® ![]() + CO +M,
+ CO +M,
5) 2![]() ¾® C2H6.
¾® C2H6.
3.1.7. Разложение диэтилового эфира протекает по
следующему механизму:
0) ![]() ,
,
1) ![]() ,
,
2) ![]() ,
,
3) ![]() .
.
Определите
суммарный порядок реакции и эффективную энергию активации, если известны
энергии разрыва связей:
|
Н5С2–ОС2Н5 |
Н–С2Н5 |
|
|
80 ккал/моль |
98 ккал/моль |
90 ккал/моль |
3.1.8. Термический распад этана на С2H4 и H2
протекает по механизму
0)
![]() ,
,
1)
![]() ,
,
2)
![]() ,
,
3)
![]() ,
,
4)
![]() ,
,
5)
![]() .
.
Выведите выражения:
1) для скорости образования С2Н4
в случаях осуществления чисто квадратичного и чисто линейного обрыва цепи;
2) для длины цепи при чисто квадратичном и чисто
линейном обрыве цепи.
3.1.9. Реакция бромирования водорода протекает
согласно следующему механизму, а энергии активации стадий равны:
0) ![]() , E0
= 190 кДж/моль,
, E0
= 190 кДж/моль,
1) ![]() , E1
= 80,6 кДж/моль,
, E1
= 80,6 кДж/моль,
2) ![]() , E2
= 5,4 кДж/моль,
, E2
= 5,4 кДж/моль,
3) ![]() , E3
= 6,5 кДж/моль,
, E3
= 6,5 кДж/моль,
4) ![]() , E4
= 8,9 кДж/моль.
, E4
= 8,9 кДж/моль.
На какую величину отличаются кажущиеся энергии активации
реакции при малой и большой степенях превращения, если условия протекания
реакции таковы, что можно воспользоваться методом стационарных
концентраций?
3.1.10.
Эффективная
энергия
активации
константы скорости образования HBr в
цепной реакции:
0)
![]() ,
,
1)![]() ,
,
2)
![]() ,
,
3)
![]() ,
,
4)
![]()
составляет 40,3 ккал/моль. Найдите выражение для
скорости образования HBr в
стационарном режиме. Определите энергию активации стадии 1, если для стадий 2 и
3 энергия активации близка к нулю, а
энергия диссоциации брома составляет 45,2 ккал/моль.
3.1.11. Для цепной реакции водорода с бромом по
механизму, приведённому в задаче 3.1.22, определите время, необходимое для установления
стационарной концентрации активных частиц, считая, что давление брома и
водорода одинаково (по 100 мм рт. ст.), а предэкспоненциальные множители для констант
скорости стадий 0 и 4 имеют нормальное значение. Т = 500 °С.
3.1.12. Сделайте оценку отношения скоростей цепного и
молекулярного процесса для реакций галогенов Х2 (Cl2, Br2, I2) с водородом, если цепной процесс идёт по механизму
0)
![]() ,
,
1)
![]() ,
,
2)
![]() ,
,
3)
![]() .
.
Стадия
3 имеет нулевую энергию активации. Энергии связей в молекулах даны в таблице (в
ккал/моль):
|
H2 |
Br2 |
I2 |
Cl2 |
HCl |
HBr |
HI |
|
103 |
45 |
36 |
57 |
102 |
86 |
71 |
Энергии активации, согласно расчёту или эксперименту,
для бимолекулярных реакций водорода с хлором, бромом и йодом равны 50, 45,
40 ккал/моль соответственно. Давление X2
в смеси
3.1.13. Окислы азота ингибируют цепную реакцию хлора с
водородом. Механизм ингибирующего действия следующий:
0)
![]()
1)
![]()
2)
![]()
3) ![]()
Найдите отношение констант k0/k3,
если при температуре 300 °С и исходных парциальных давлениях газов (в
мм рт. ст.) PNO = 1, PNOCl = 6,
PH2 = 50, PСl2 = 50
изменение давления HСl на
10 мм рт. ст. происходит за 300 с. В этих условиях k1 = 7 × 108 л/(моль×с).
3.1.14. В газовой фазе фотосенсибилизированное йодом
разложение йодистого этила идёт по механизму
0)
![]()
1)
![]()
2)
![]()
Выясните, как будет зависеть скорость разложения от
интенсивности падающего на реактор света, в случаях, когда гибель атомов йода идёт: 1) в результате тройных соударений
по реакции ![]() или 2) путём
рекомбинации на стенке.
или 2) путём
рекомбинации на стенке.
3.1.15. Реакция гидрирования этилена в газовой фазе
протекает по схеме
0)
![]()
1)
![]()
2)
![]()
3)
![]()
Эффективная энергия активации процесса равна
42 ккал/моль. Определите энергию активации стадии 1, считая, что энергия
активации взаимодействия двух радикалов равна нулю, а энергия разрыва связей в
молекуле водорода составляет 104 ккал/моль, С–Н в этане 98 ккал/моль, С–Н в этильном радикале
39 ккал/моль.
3.1.16. Реакция разложения ацетальдегида протекает по цепному механизму
0)
![]()
1)
![]()
2)
![]()
3)
![]()
Энергия активации для реакции распада радикала ![]() составляет
12 ккал/моль, а энергия связи С–С
в ацетальдегиде 81 ккал/моль. Рассчитайте эффективное значение
предэкспоненциального множителя и энергию активации для процесса в целом.
составляет
12 ккал/моль, а энергия связи С–С
в ацетальдегиде 81 ккал/моль. Рассчитайте эффективное значение
предэкспоненциального множителя и энергию активации для процесса в целом.
3.1.17. Полагая, что разложение этана идёт в
соответствии с механизмом
0)
![]()
1)
![]()
2)
![]()
3)
![]()
4) ![]()
а энергии активации для стадий 0 и 2 составляют 88 и
40 ккал/моль соответственно, оцените эффективную скорость разложения этана
при 500 °С и РС2Н6 =
3.1.18. Определите начальную скорость и длину цепи в
реакции крекинга пропана при 100 мм рт. ст. в присутствии
0,1 мм рт. ст. кислорода
при 1000 К, если процесс идёт по схеме
0) C3H8 + O2 ¾® Ċ3H7 + H![]() ,
,
1) Ċ3H7 ¾® ĊH3 + C2H4,
2) ĊH3 + C3H8 ¾® Ċ3H7 + CH4,
3) ĊH3 ¾® гибель на стенке.
Энергии активации рассчитайте из энергий разрыва
связей, полагая, что для реакций взаимодействий двух радикалов Е = 0, для
реакций замещения справедливо правило Поляни – Семенова. Предэкспоненциальные множители вычислить, считая
стерический фактор равным единице, а сечение
соударения для всех реакций 2 × 10–15 см2. Кроме того, положить, что k3 = 30 c–1,
энергии разрыва связей (ккал/моль): ЕН–О2 = 47,
ЕСН3–Н = 101, ЕС3Н7–Н =
100.
3.1.19.
Изучение
механизма цепной неразветвлённой реакции между А2 и В2
(А2 + В2 ¾® 2 АВ) показало, что стадией зарождения
цепей является реакция А2 ¾® 2 А.
Суммарная энергия активации процесса равна 54 ккал/моль, а радикал В значительно менее активен по сравнению
с радикалом А. Зависимость периода
индукции реакции tинд
от температуры в присутствии одинакового количества эффективного ингибитора
дана в таблице.
|
T, К |
607 |
623 |
644 |
671 |
|
tинд, мин |
190 |
60 |
12 |
1 |
Напишите схему процесса, полагая, что рекомбинация
радикалов происходит без участия третьей частицы. Найдите энергию активации
лимитирующей стадии реакции продолжения цепи и энергию активации для реакции
зарождения радикалов.
3.1.20.
При
изучении механизма окисления кумола измерялось время расходования кислорода при
60 °С в зависимости от концентрации кумола RH:
|
t, c |
0,17 |
0,14 |
0,11 |
0,095 |
0,083 |
|
[RH],
моль/л |
0,3 |
0,4 |
0,6 |
0,8 |
0,9 |
Окисление идёт по механизму
0) ![]() ,
,
1) ![]()
2) ![]()
3) ![]()
Найдите отношение ![]() , если W0 = 7,3 × 10–7 М×с–1 и [RH] >> [O2].
, если W0 = 7,3 × 10–7 М×с–1 и [RH] >> [O2].
3.1.21. Скорость фотохимически инициированной
радикальной полимеризации метилметакрилата CH2=C(CH3)–COOCH3
пропорциональна ![]() (I – интенсивность света) и составляет
3,6 × 10–4 М×с–1, а средняя молекулярная масса образующегося полимера » 106. Константа скорости
гибели радикалов » 109 М–1×c–1. Какова стационарная
концентрация радикалов?
(I – интенсивность света) и составляет
3,6 × 10–4 М×с–1, а средняя молекулярная масса образующегося полимера » 106. Константа скорости
гибели радикалов » 109 М–1×c–1. Какова стационарная
концентрация радикалов?
3.1.22. При облучении сосуда, содержащего Cl2 и СО в равных количествах, образуется фосген по следующему механизму
0) ![]() ,
,
1) ![]() ,
,
2) ![]() ,
,
3) ![]() .
.
Получите выражение для скорости реакции в стационарном
режиме и оцените время выхода на стационарный режим, если реакция протекает в сферическом сосуде диаметром
3.1.23. Разложение этана протекает по схеме
0)
![]() DH = +368 кДж/моль,
DH = +368 кДж/моль,
1)
![]() DH = –17
кДж/моль,
DH = –17
кДж/моль,
2)
![]() DH = +163 кДж/моль,
DH = +163 кДж/моль,
3)
![]() DH = –25
кДж/моль,
DH = –25
кДж/моль,
4)
![]() DH = –410
кДж/моль.
DH = –410
кДж/моль.
Определите суммарный порядок и
эффективную энергию активации процесса.
3.1.24. Сосуд
объёмом 100 см3, содержащий стехиометрическую смесь водорода с
хлором при 0 °С, облучается светом с длиной волны 400 нм, при этом
молекулами хлора поглощается 11 × 10–7 Дж/с световой энергии.
За одну минуту облучения парциальное давление хлора понижается с 205 до
156 торр. Определите длину цепи.
3.1.25. (КР3–2003, № 3). В эквимолекулярной смеси СНСl3 и Сl2 при Р = 1 атм и Т = 380 К в условиях фотохимического
инициирования протекает цепная реакция
0) ![]() ,
,
1) ![]() ,
,
2) ![]() ,
,
3) ![]() .
.
Энергии связей Cl–Cl и Сl–CCl3 равны 252 и 319 кДж/моль соответственно.
Найдите эффективный порядок реакции и эффективную энергию активации процесса.
3.1.26.
(Экз–2003,
№ 3). Освещение эквимолекулярной смеси СН3Сl и Сl2 при Р = 1 атм и Т = 380 К вызывает цепную
реакцию, протекающую по схеме
|
0) 1) |
2) 3) |
На каждый поглощенный квант света образуется 50
молекул CCl4. Рассчитайте скорость
реакции образования CCl4,
если энергия активации стадии 2 составляет 33,5 кДж/моль. Предэкспоненциальные
множители считать нормальными.
3.1.27. (КР3–2004, № 5). Цепное термическое разложение
диметилового эфира протекает по следующему механизму:
0) С2H5OC2H5 ¾® ![]()
1) ![]() ¾® C2H5 +
¾® C2H5 + ![]()
2) ![]() ¾®
¾® ![]()
3) ![]() ¾® C2H4 + C2H6.
¾® C2H4 + C2H6.
Найдите суммарный порядок реакции.
3.1.28. (Экз–2004, № 2). Оцените время установления
90 % от стационарной концентрации атомов Cl в цепной неразветвлённой реакции с
фотохимическим инициированием
Н2 + Сl2 ¾® 2 HCl
при 27 °С в присутствии 1,3 Па NOCl, если обрыв цепи
происходит по реакции
Cl + NOCl ¾® Cl2 + NO,
протекающей без энергии активации.
3.1.29. (Пе1–2004, № 2). Цепное окисление некоторого
углеводорода молекулярной массой 100 в газовой фазе протекает по схеме
0) ![]()
![]()
1) ![]() + O2 ¾®
+ O2 ¾® ![]()
2) ![]() ¾®
¾® ![]()
3) ![]() ¾®
¾® ![]()
Оцените длину цепи, если гибель происходит в
кинетической области с коэффициентом прилипания ε = 10–3,
радиус цилиндрического сосуда ![]() = 10–10 см3/с и Е2
= 40 кДж/моль.
= 10–10 см3/с и Е2
= 40 кДж/моль.
3.1.30. (Экз–2005, № 4). Автоокисление альдегидов в
хлороформе описывается схемой
0) RH + O2 ¾® R· + HO2· E0 = 126 кДж/моль,
1) R· + O2 ¾® RO2· E1 = 0 кДж/моль,
2) RO2· + RH ¾® RO2H + R· E2 = 25 кДж/моль,
3) 2 RO2· ¾® гибель k3 = 1010 M–1c–1.
Если же процесс вести в толуоле, то добавляется
реакция
4) RO2· + PhCH3
¾® RO2H + PhCH2· E4 = 55 кДж/моль.
Бензильный и НО2· радикалы в дальнейших превращениях не участвуют. [RH] =
3.1.31.
(Экз–2005,
№ 5). Неразветвлённая цепная реакция термического разложения этана протекает по
следующему механизму:
|
№ |
элементарная реакция |
предэкспонент, с–1 или см3/(моль с) |
энергия |
|
0) |
С2Н6 + С2Н6
¾® 2 СН3
+ С2Н6 |
6,5 × 1017 |
293 |
|
1) |
СН3 + С2Н6 ¾® СН4
+ С2Н5 |
2,0 × 1011 |
43 |
|
2) |
С2Н5 ¾® С2Н4 + Н |
3,0 × 1014 |
165 |
|
3) |
Н + С2Н6 ¾® Н2
+ С2Н5 |
3,4 × 1012 |
28 |
|
4) |
С2Н5 + С2Н5
¾® С4Н10 |
1,6 × 1012 |
0 |
Воспользовавшись приведёнными значениями
предэкспонента и энергий активации элементарных стадий, рассчитайте
стационарную концентрацию атомов водорода и этильных радикалов в зоне реакции при
температуре 600 °С и давлении 400 торр.
3.1.32. (Экз–2007, № 4). Оцените длину цепи
термической реакции хлорирования водорода в присутствии 0,001 % ингибитора NCl3, если обрыв цепи происходит по реакции Cl + NCl3 ¾® Cl2 + NCl2, протекающей без энергии активации, а энергия активации лимитирующей
стадии продолжения цепи Cl + H2 ¾® HCl + H равна 24,1 кДж/моль.
Смесь хлора с водородом стехиометрическая, температура 220 °С.
3.1.33. Хемилюминесценция возникает при рекомбинации перекисных
радикалов RO·2, принимающих участие в элементарных стадиях процесса окисления.
Измеряя интенсивность хемилюминесценции (I),
которая пропорциональна скорости рекомбинации RO2·, т. е. I = a×[RO2·]2, можно следить за концентрацией этих
радикалов в ходе реакции.
При окислении кумола радикалы RO2· образуются под действием света со скоростью W0
= 5 × 10–8 М×с–1 при 90 °С. После
выключения света интенсивность хемилюминесценции падает.
|
t, c |
5 |
10 |
20 |
30 |
50 |
|
I/I0 |
0,59 |
0,44 |
0,27 |
0,18 |
0,09 |
Определите по результатам этого опыта константу
скорости рекомбинации перекисных радикалов в этой системе (метод
фотохимического последействия).
3.1.34. В системе происходит процесс
A ![]()
![]()
![]()
![]()
![]()
![]()
![]() C.
C.
B стационарном режиме W = 10–10 M×с–1.
В момент времени t = 0 в эту стационарную систему
напускается О2, и радикалы![]() мгновенно реагируют с О2:
мгновенно реагируют с О2:
![]()
![]()
![]()
![]()
![]() П + hn.
П + hn.
Интенсивность
хемилюминесценции (I) при этом
возрастает в соответствии с таблицей. Найдите значения констант k2
и k4.
|
t, с |
2 |
5 |
10 |
15 |
¥ |
|
I/I¥ |
0,29 |
0,63 |
0,9 |
0,98 |
1 |
3.1.35. В отсутствие кислорода в жидком этилбензоле
при 36 °С образуются алкильные радикалы R1· за счёт распада инициатора бис-a-азоэтилбензола со скоростью W1 = 1,75 × 10–11 М×с–1. Радикалы R1· быстро взаимодействуют с этилбензолом с
образованием радикалов R·, а последние рекомбинируют с W3 = k3
[R·]2.
После достижения стационарного режима система быстро насыщается
кислородом и радикалы R· практически мгновенно превращаются в RO2·. После напуска кислорода наблюдается рост
интенсивности хемилюминесценции во времени из-за рекомбинации радикалов RO2· (k4).
|
t, c |
10 |
25 |
50 |
75 |
¥ |
|
I/I¥ |
0,29 |
0,63 |
0,90 |
0,98 |
1 |
Определите по этим результатам константы скорости
реакций рекомбинации алкильных и перекисных радикалов (метод кислородного
последействия).
3.1.36. В реакции инициированного окисления
циклогексана при 70 °С изучалась зависимость скорости расходования
ингибитора окисления a-нафтиламина от концентрации ингибитора.
|
[InH] × 103, моль/л |
0,1 |
0,25 |
0,5 |
1,0 |
2,0 |
|
W × 107, моль/л×с |
0,5 |
1,2 |
1,9 |
2,0 |
2,0 |
Определите по этим данным отношение ![]() ,
,
![]() +
+![]()
![]() продукты,
продукты,
InH + ![]()
![]() ROOH +
ROOH + ![]() ,
,
и скорость инициирования W0.
3.1.37. (КР3–2006, №3). Неразветвленная цепная реакция
гидрирования этилена протекает по схеме:
0) ![]() ,
,
1) ![]() ,
,
2) ![]() ,
,
3) ![]() .
.
Рассчитайте стационарную концентрацию этильных
радикалов и атомов водорода при температуре 600 оС и
атмосферном давлении стехиометрической смеси этилена с водородом, считая, что
энергии активации взаимодействия двух радикалов равны нулю, а энергии разрыва
связей Н–Н = 434 кДж/моль, Н–С2Н5 = 410
кДж/моль, Н–С2Н4
= 165 кДж/моль.
3.1.38. . (КР3–2007, №1). Определите температуру, при
которой время
полупревращения в реакции хлорирования водорода составит 100 секунд. Смесь
стехиометрическая, ![]() .
.
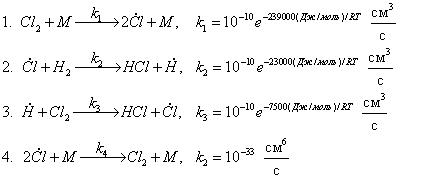
3.1.39. (КР3–2008, № 1). Найдите скорость
дегидрирования этана при давлении 1 атм. и температуре 1000 К, если газовая
смесь содержит в равных количествах этан, этилен и водород.
0) C2H6 → 2CH3 k0
= 1,55×10–3 с–1,
1) CH3 + C2H6 → C2H5 + СН4 k1 = 2,41×107 л моль–1 с–1,
2) C2H5 → C2H4 + H k2
= 4,15×104 с–1,
3) H + C2H6 → H2 + C2H5 k3 = 8,13×108 л
моль–1 с–1,
4) H + C2H4 → C2H5 k4 = 9,14×109 л
моль–1 с–1,
5) 2C2H5 → C2H4 + C2H6 k5 = 1,15×1011
л моль–1 с–1.