4. катализ и реакции на поверхности
4.2. Гомогенный катализ
4.2.1. Предложите
простейшую каталитическую схему для реакции
A ![]() В.
В.
Исходя из предложенной схемы, покажите,
что катализатор не смещает равновесия реакции. Может ли порядок этой
реакции по веществу В зависеть от его
концентрации?
4.2.1. Покажите, что
вблизи термодинамического равновесия реакционной среды скорость каталитической
реакции пропорциональна текущему значению сродства катализируемой реакции.
4.2.2.
Каталитическая реакция
S1 + S2 ¾® P1 + P2
протекает в присутствии слабой кислоты НА по механизму:
1) S1 + HA ![]() S1H+ + A–,
S1H+ + A–,
2) S1H+ + S2 ![]() P2H+ + P1,
P2H+ + P1,
3) P2H+ + A– ![]() P2 + AH,
P2 + AH,
4) P2H+ + H2O ![]() P2 + H3O+,
P2 + H3O+,
5) H3O+ + A– ![]() AH + H2O.
AH + H2O.
Известно, что реакция лимитируется
стадиями депротонирования продукта реакции, а стадии (1), (2), и (5) являются
быстрыми и равновесными.
Каким (общим или специфическим)
является катализ данной реакции кислотой НА,
если:
а) стадия (3) протекает значительно
быстрее, чем стадия (4);
б) стадия (4) протекает значительно
быстрее, чем стадия (3)?
Ответ обоснуйте для обоих случаев.
4.2.3. Выведите
выражение, связывающее кислотность
среды ho и скорость Wкат каталитической реакции ![]() , протекающей в сильнокислотной среде по механизму
, протекающей в сильнокислотной среде по механизму
S + AH ![]() SH+ + A–,
SH+ + A–,
SH+ ![]() PH+,
PH+,
PH+ + S ![]() P + SH+ (быстро).
P + SH+ (быстро).
4.2.4. Кислотно-каталитическая
реакция В ¾® Р протекает
согласно механизму
B + AH ![]() BH+ + A–,
BH+ + A–,
BH+ ![]() PH+,
PH+,
PH+ + В ![]() P + ВH+ (быстро).
P + ВH+ (быстро).
Определите зависимость наблюдаемой
константы скорости реакции от кислотности среды h0, если
скорость депротонизации вещества ВН+ больше, чем скорость его
превращения в продукт.
4.2.5. Каталитическая
реакция синтеза C6H6COC6H5 по методу
Фриделя – Крафтса осуществляется в присутствии AlCl3 по механизму
C6H5COCl + AlCl3 ![]() C, k1
= 102 M–1×c–1, k–1 = 1,0 c–1,
C, k1
= 102 M–1×c–1, k–1 = 1,0 c–1,
C + C6H6 ![]() AlCl3 + HСl + C6H6COC6H5.
AlCl3 + HСl + C6H6COC6H5.
При [C6H5COCl] = [C6H6] = 10–
4.2.6. Гидролиз
уксусного ангидрида (CH3CO)2O катализируется как гидроксил-анионом OH–:
(CH3CO)2O + OH– ![]() CH3COOH + CH3COO–, k1 = 10 M–1c–1,
CH3COOH + CH3COO–, k1 = 10 M–1c–1,
так и ионом гидроксония H3O+:
(CH3CO)2O + H3O+ ¾® [(CH3CO)2 × H3O]+ ¾® 2 CH3COOH + H3O+.
Эффективная константа кислотного гидролиза равна 7 × 10–3 М–1с–1.
При каком рН водного раствора уксусный ангидрид будет наиболее устойчив?
4.2.7.
Каталитическая
реакция идёт по схеме
A + K ![]() AK,
AK,
AK + B ![]() K + C.
K + C.
В двух опытах при следующих начальных концентрациях реагентов были
получены привёденные в таблице значения времён превращения А на 50 % и 75 %.
|
[K]0 моль/л |
[A]0 моль/л |
[B]0 моль/л |
t50 % |
t75 % |
|
10–6 |
0,1 |
0,2 |
8 ч 50 мин |
18 ч |
|
10–6 |
0,1 |
0,3 |
6 ч 30 мин |
|
Найдите
константы скорости k1, k2, k3. Концентрацию AK считать
стационарной.
4.2.8. Стереоспецифическое гидрирование антроповой
кислоты на гомогенном Rh-содержащем
катализаторе протекает по следующей схеме
(I) (II)

(III) (IV)
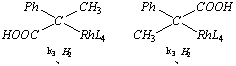
![]()
(V) (VI)
При какой разности энергий Гиббса образования
промежуточных продуктов III и IV (![]() ) оптическая чистота продукта гидрирования составит
80 %? Характерные времена установления равновесий I
) оптическая чистота продукта гидрирования составит
80 %? Характерные времена установления равновесий I ![]() III и I
III и I ![]() IV равны tIII и tIV и много меньше характерных времен реакций III ¾® V, IV ¾® VI.
IV равны tIII и tIV и много меньше характерных времен реакций III ¾® V, IV ¾® VI.
Пояснение: оптическая
чистота продукта равна отношению (СV – CVI) / (CV + CVI).
4.2.9. При окислении углеводорода
RH на порфиринах металлов (ПФ)
предполагалась следующая схема реакции:
1) ПФ
+ О2 ![]() ПФ × О2,
ПФ × О2,
2) ПФ × О2 ![]() ПФ + О2,
ПФ + О2,
3) ПФ × О2 + RH ![]() ПФ × О2 × RH,
ПФ × О2 × RH,
4) ПФ × О2×RH ![]() ПФ × О2 + RH,
ПФ × О2 + RH,
5) ПФ × О2×RH ![]() ПФ + ROOH.
ПФ + ROOH.
Выведите кинетическое уравнение для накопления
продукта реакции ROOH: а) предполагая, что стадия (5) лимитирующая; б)
методом стационарных концентраций.
4.2.10. В ходе кислотно-каталитического гидролиза белка
при повышенной температуре параллельно с процессом гидролиза происходит
термическая денатурация белка, сопровождающаяся потерей его водорастворимости:
1) S + H+![]() C, 2) C ¾® P + H+, 3)
S ¾® D.
C, 2) C ¾® P + H+, 3)
S ¾® D.
Равновесие протонирования белка устанавливается
быстро. K1 = 103 M–1,
k2 = 102 c–1, k3 = 50 c–1.
1. Рассчитайте процент гидролиза
белка к моменту завершения реакции при введении 10–5 М белка в раствор кислоты с рН = 3.
2. Во сколько раз
изменится начальная скорость и конечный процент гидролиза белка при 5-кратном
увеличении концентрации ионов водорода?
4.2.11. Окисление
щавелевой кислоты Н2А в водном растворе в присутствии
водорастворимого сульфофталоцианина кобальта (Co) описывается схемой
1) H2A ![]() H+
+ HA–,
H+
+ HA–,
2) HA– ![]() H+
+ A2–,
H+
+ A2–,
3) Co + HA– ![]() [Co × HA–],
[Co × HA–],
4) [Co × HA–] + O2 ![]() [Co × HA–] × O2,
[Co × HA–] × O2,
5) [Co × HA–] × O2 ¾® Co + продукты.
Найдите суммарное
кинетическое уравнение для скорости реакции, в том числе зависимость этой
скорости от pH. Стадии (1)–(4) равновесные.