4. катализ и реакции на поверхности
4.5. Гетерогенный катализ
Адсорбционное равновесие
4.5.1.
На основании теории абсолютных скоростей реакций
оцените предэкспоненциальный фактор константы скорости тримолекулярного
процесса
А + В +
С ¾® продукт.
Предполагается, что частицы А, В и С
адсорбированы на однородной поверхности. Сравните с фактором тройных соударений в газе.
4.5.2.
Исходя из постулата о независимости элементарных
превращений, выведите закон действующих
масс для бимолекулярной реакции между молекулами газа и адсорбированными
молекулами
A + Bадс ¾® Р.
4.5.3. Для гетерогенной каталитической реакции
Агаз + Вгаз ¾® Ргаз
скорость прямо пропорциональна концентрации вещества А в газовой фазе и обратно пропорциональна концентрации вещества В в газовой фазе. Предложите механизм
для такой реакции и выведите выражение для её скорости.
4.5.4. Гидрирование этилена на поверхности меди
C2H4 + H2 ![]() C2H6
C2H6
характеризуется эффективной энергией активации 10 ккал/моль. В условиях эксперимента водород адсорбируется на поверхности
меди слабо, слабо адсорбируются этилен и этан. Тепловые эффекты адсорбции
водорода и этилена равны 11 и 16 ккал/моль соответственно. Какова
истинная энергия активации реакции адсорбированных на поверхности меди этилена
и водорода?
4.5.1. Гетерогенно-каталитическая реакция
CO2 + H2 ![]() CO + H2O
CO + H2O
проводится в условиях непрерывного удаления продуктов реакции. Скорость
реакции при низком давлении CO2 пропорциональна PCO2, а при высоком – обратно пропорциональна квадрату PCO2.
Максимум скорости (при PH2 = const) наблюдается при PCO2 = 200 торр. В
широком интервале давлений H2 скорость реакции пропорциональна PH2.
1. Найдите величину константы равновесия адсорбции СО2 на Pt в
единицах торр–1.
2. Выведите выражение для времени полупревращения при различных начальных
давлениях PH2 и PCO2.
4.5.2.
Реакция 2 Аgas![]() Bgas идёт по схеме
Bgas идёт по схеме
1) Agas + Z ![]() (AZ),
(AZ),
2) 2 (AZ) ![]() Bgas + 2 Z (быстро),
Bgas + 2 Z (быстро),
где Z – пустая ячейка поверхности.
Установите соотношение между скоростями прямой и обратной реакции.
4.5.3.
Окисление метана на платине может происходить по
двум параллельным каналам: 1) путём реакции адсорбированных молекул кислорода и
метана; 2) путём «удара» молекулы метана, налетающей из газовой фазы, по
адсорбированной молекуле кислорода.
Найдите выражение для общей скорости реакции и порядки реакции по
концентрации обоих компонентов в газовой фазе. Изобразите зависимость скорости каталитической реакции
от концентрации кислорода.
4.5.4.
(П2–2005, № 4). На поверхности катализатора происходит одновременная адсорбция двух
газов
1) А + Z ![]() ZА,
ZА,
2) B + Z
![]() ZВ
ZВ
и затем бимолекулярная реакция
3) ZА + ZВ ![]() Р + 2 Z .
Р + 2 Z .
Выведите выражение для скорости реакции A + B ¾® P.
4.5.5.
Гетерогенная каталитическая реакция А + В ¾® С протекает по
механизму
1) A ![]() Aadc,
Aadc,
2) B ![]() Badc,
Badc,
3) Aadc + Badc ![]() Cadc,
Cadc,
4) C ![]() Cadc,
Cadc,
где А, В и С – газы. Выведите
уравнение для скорости накопления вещества С,
если известно, что стадия (3) является лимитирующей, а стадии (1), (2) и (4) –
равновесные. В каких пределах может изменяться порядок реакции по веществам А, В
и С? В каких пределах может
изменяться наблюдаемая энергия активации реакции при изменении давления веществ
А, В и С?
4.5.6.
Каталитическая реакция А2 + 2В
= 2 АВ протекает по механизму
1) 2 Z + A2 ![]() 2 ZA (квазиравновесная
стадия),
2 ZA (квазиравновесная
стадия),
2) ZA + B ¾®
AB + Z,
где Z – активный центр. Определите
энергию активации стадии (2) и теплоту адсорбции А2, если известно, что при порядках реакции по
компоненту А2 равных 0,4 и
0,1 кажущиеся энергии активации реакции составляют 5 и 15 ккал/моль
соответственно. Какой порядок будет наблюдаться по
компоненту В?
4.5.7.
Механизм окисления СО на некоторых металлах может быть описан следующей
последовательностью реакций:
O2 + 2 Z ![]() 2 Oадс,
2 Oадс,
СO + Oадс ![]() CO2 + Z,
CO2 + Z,
где Z означает адсорбционное место на
поверхности.
1. Получите выражение для
скорости реакции, если первая стадия быстрая и равновесная.
2. При какой степени
покрытия q0
поверхности металла кислородом кажущийся порядок реакции по кислороду будет
равняться 0,4?
3.
Чему будет равняться кажущаяся энергия активации при этой степени покрытия,
если DНадс = –32 ккал/моль, а Е2 =
18 ккал/моль?
4.5.8.
Выведите кинетическое уравнение для гетерогенной
каталитической реакции
СО + О2 ![]() СО2,
СО2,
протекающей по механизму
2 Z + O2 ¾®
2 ZO,
Z + CO ![]() ZCO,
ZCO,
ZO + ZCO ![]() 2 Z
+ CO2.
2 Z
+ CO2.
4.5.9.
Окисление СО
на некоторых металлах описывается механизмом
O2 + 2 Z ![]() 2 Oадс,
2 Oадс,
СO + Oадс ![]() CO2 + Z,
CO2 + Z,
Известно, что энергия активации стадии (2) равна 18 ккал/моль, стадия (1)
быстрая и равновесная, DНадс = –32 ккал/моль.
При
какой степени покрытия поверхности кислородом q0 кажущаяся энергия активации реакции будет » +6 ккал/моль?
4.5.10.
Начальная стадия каталитического пиролиза метана
может быть описана следующей схемой:
CH4 ![]() CH3 + Hs,
CH3 + Hs,
2 CH3 ¾® C2H6,
Hs + Hs ¾® H2,
в которой первая и третья реакции протекают на поверхности катализатора, а
вторая – в газовой фазе. Определите, как скорость образования этана зависит от
отношения S/V поверхности катализатора к свободному объему системы. Полагать, что
процесс протекает в замкнутой системе, а заполнение поверхности
адсорбированными атомами водорода (Hs)
гораздо меньше монослойного.
4.5.11.
В замкнутой системе протекает
гетерогенная каталитическая реакция А + В ¾® С. Полученная при этом зависимость СА
от времени для стехио-метрической смеси приведена на рисунке.
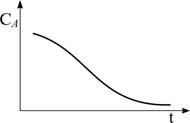
Определите, по какому из трёх предполагаемых механизмов протекает реакция
|
Механизм 1 |
Механизм 2 |
Механизм 3 |
|
A + Z |
A + Z |
A + Z |
|
B + Z |
B + Z |
B + Z |
|
BZ + AZ ¾® C +
2Z |
BZ + A ¾® C + Z |
AZ + B ¾® C + Z |
Последняя стадия во
всех случаях лимитирующая.
4.5.12. (Экз–2003, № 2). На гетерогенном катализаторе
массой m и удельной
адсорбционной емкостью N0
моль×г–1 идёт изомеризация бутана по
схеме
n-C4H10 + Z ![]() {n-C4H10Z},
{n-C4H10Z},
{n-C4H10Z} ![]() {i-C4H10Z}.
{i-C4H10Z}.
Адсорбция n-бутана
быстрая и равновесная, изобутан не десорбируется. Найдите зависимость
количества адсорбированного изобутана от времени, считая концентрацию n-бутана в газовой фазе постоянной.
4.5.13.
(Экз–2006,
№ 2). Окисление ацетона пероксидом водорода на железосодержащем катализаторе
хорошо описывается механизмом Лэнгмюра – Хиншельвуда:
Ac + Z1 ![]() Z1Ac,
Z1Ac,
H2O2 + Z2 ![]() Z2H2O2,
Z2H2O2,
Z1Ac + Z2H2O2 ![]() Z1 + Z2 + продукты.
Z1 + Z2 + продукты.
Ацетон и перекись водорода адсорбируются на разных центрах поверхности. Оцените константу равновесия КН2О2
для адсорбции Н2О2 на катализаторе по
экспериментальной зависимости начальной скорости окисления ацетона от начальной
концентрации Н2О2.
4.5.14.
(Пе1–2007,
№ 4). Каталитическая реакция паровой конверсии метана протекает по механизму
1)
СН4 + Z ![]() ZCH2 + H2, (равновесная)
ZCH2 + H2, (равновесная)
2) ZCH2 + H2O ![]() ZCO + 2 H2,
ZCO + 2 H2,
3) ZCO ![]() CO + Z,
(равновесная).
CO + Z,
(равновесная).
Выведите выражение для скорости реакции.
4.5.15.
(Экз–2008,
№ 5). Каталитическая изомеризация a-пинена (A) в b-пинен (B) протекает на
поверхности палладиевого катализатора через образование промежуточного
каталитического комплекса (C) с хемосорбированным атомом водорода (H):
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Адсорбция изомеров пинена и диссоциативная адсорбция водорода протекают на
различных адсорбционных центрах поверхности. Найдите выражение для стационарной
скорости реакции изомеризации, выразив её через концентрации реагентов.
4.5.16.
Выведите кинетическое уравнение для гетерогенной
каталитической реакции
2 H2 + O2 ¾® H2O,
протекающей по механизму
H2 + 2 Z ![]() 2 HZ,
2 HZ,
O2 + 2 Z ![]()
HZ + OZ ![]() OHZ + Z,
OHZ + Z,
OHZ + HZ ![]() H2O × Z,
H2O × Z,
H2O × Z ![]() H2O +
Z,
H2O +
Z,
при условии, что Н2О адсорбируется сильно.
4.5.17.
Предлагая следующий механизм каталитической
реакции окисления водорода
1) Z +
O2 ![]() ZO2,
ZO2,
2) ZO2 + Z ![]() 2 ZO,
2 ZO,
3) 2 Z + H2 ![]() 2 ZH,
2 ZH,
4) ZO + ZH ¾® ZOH +Z,
5) ZOH + ZH ¾® 2 Z + H2O,
6) ZO2 + 2 ZH ¾® 2 ZOH + Z,
запишите систему уравнений, необходимую и достаточную
для получения выражения скорости реакции в стационарных условиях. Определите
число независимых маршрутов и стехиометрические числа стадий для этих
маршрутов.